Daniele Barbaro a, Giuseppina Porcarob e Salvatore Benvenga c,d
aUnità di Endocrinologia Asl Nord Ovest, Toscana, Italia
bCentro della Salute della donna, Terni, Italia
cDipartimento di Medicina Clinica e Sperimentale, Università di Messina, Messina, Italia
dProgramma Interdipartimentale di endocrinologia Molecolare e Clinica e di Salute Endocrinologica della Donna, Ospedale Universitario, Messina, Italia
L’ormone tireostimolante (TSH) è il principale regolatore fisiologico della crescita e del funzionamento del componente epiteliale (endodermico) della tiroide: le cellule follicolari, chiamate anche tireociti. Oltre alla complessa regolazione della sintesi degli ormoni tiroidei (a partire dall’impulso di assorbimento dell’iodio) e della secrezione di questi ultimi nel torrente sanguigno, il TSH regola anche la replicazione e la differenziazione dei tireociti. La maturazione dell’asse pituitario-tiroideo e la successiva stimolazione della crescita e del funzionamento della tiroide da parte del TSH iniziano dal terzo trimestre di gestazione, poiché lo sviluppo precoce della tiroide e la sintesi della tireoglobulina (Tg) all’inizio della follicologenesi sono indipendenti dal TSH. Di conseguenza, la compromissione della sintesi di TSH o della segnalazione del TSH dovuta, ad esempio, a mutazioni inattivanti del recettore del TSH (TSHR), possono causare l’ipoplasia tiroidea ma non l’atireosi. Una volta secreto dalla ghiandola pituitaria anteriore, il TSH si lega al suo recettore (TSHR), che si trova sul lato basolaterale della membrana plasmatica dei tireociti. Come noto, il TSHR è un recettore di membrana accoppiato a proteine G che attiva secondi messaggeri. Questi effetti sono in gran parte mediati dall’incremento delle concentrazioni intracellulari di AMP ciclico (cAMP) che segue il legame TSH-TSHR. Oltre al cAMP (e alla proteina chinasi A [PKA] dipendente dal cAMP), il TSH attiva la via della fosfolipasi C (PLC)-dipendente dell’inositolo fosfato Ca2+/diacilglicerolo (DAG), con la principale formazione dell’inositolo 1,4,5-trifosfato (IP3). L’IP3 aumenta la concentrazione di calcio intracellulare favorendone il rilascio dal reticolo endoplasmatico. Questa dualità dei messaggeri si applica anche per l’’attività stimolante del TSHR da parte delle immunoglobuline circolanti associate alla malattia di Graves [1-3].
Oltre all’IP3, come spiegato più nel dettaglio successivamente in questo libro, altri inositoli (IS) sono noti come secondi messaggeri il cui ruolo sta guadagnando sempre più interesse nella regolazione di diverse vie metaboliche ed endocrinologiche. Gli IS presentano una struttura cicloesanica con sei gruppi idrossilici, con 9 diversi stereoisomeri con diversi gradi di fosforilazione, il mio-inositolo (MI) e il D-chiro-inositolo (DCI), che sono gli stereoisomeri più studiati, nel complesso possono essere fosforilati in sette posizioni possibili. Gli IS possono essere sintetizzati ex novo a partire dal glucosio-6-fosfato o introdotti attraverso la dieta, raramente incorporati nelle membrane cellulari nelle forme fosforilate chiamate fosfoinositidi (PPI), che costituiscono circa l’1% dei fosfolipidi totali. Grazie alle diverse posizioni di fosforilazione del cicloesanolo poliolico svolgono ruoli diversi nelle funzioni cellulari [4].
Le singole fosforilazioni sono particolarmente coinvolte nella regolazione dell’endocitosi e del traffico cellulare. D’altra parte, specifiche chinasi lipidiche possono modificare l’estensione della fosforilazione, con i polifosfati IS che sembrano agire principalmente come secondi messaggeri per la replicazione cellulare. Come già indicato, uno degli IS più studiati è l’IP3, che agisce come secondo messaggero per alcuni ormoni peptidici, tra cui il TSH.
Al contrario, altri IS polifosfati (3,4 e 3,4,5) mediano principalmente l’azione dei fattori di crescita sui tireociti. Dopo il legame dei fattori di crescita ai loro recettori, l’inositolo 3-4 viene rilasciato dalla membrana cellulare; dopo ulteriori fosforilazioni, può legarsi al dominio che inattiva l’AKT, una proteina chinasi serina/treonina-specifica nota anche come proteina chinasi B. Le mutazioni attivanti nelle proteine della via PI3K/Akt/mTOR sono implicate nella tumorigenesi, compreso il cancro alla tiroide (Figura 1). Per questi motivi, i suddetti polifosfati IS (polifosfati 3,4 e 3,4,5) potrebbero svolgere un ruolo protettivo (antitumorale). Possono essere generati anche IS maggiormente fosforilati, ma il loro ruolo non è ancora completamente chiaro [1-4].
Poiché gli IS influenzano il funzionamento e la replicazione dei tireociti, di seguito discuteremo l’effetto della supplementazione con il mio-inositolo (MI), che è l’IS più abbondante, nell’ipotiroidismo, in particolare sull’ipotiroidismo subclinico (SCH) e sulla tumorigenesi tiroidea.
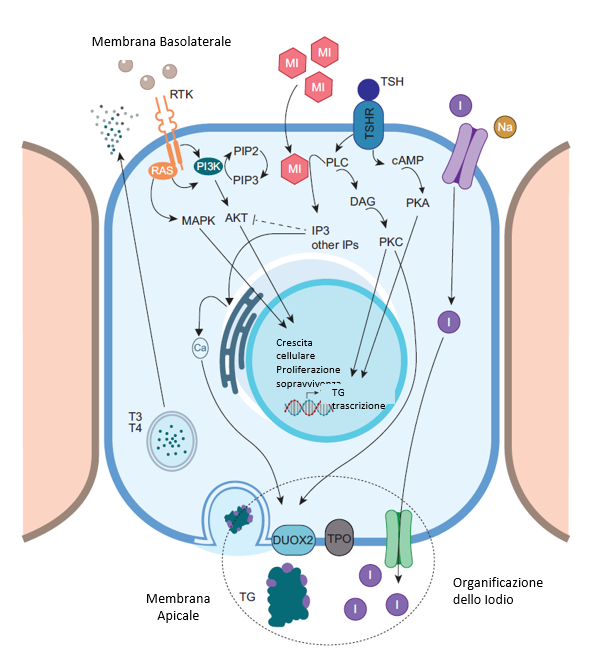
Fig.1 Rappresentazione schematica della sintesi e della secrezione degli ormoni tiroidei ni tireociti. Il Mio-inositolo (MI) è coinvolto nella cascata fosforilativa che risulta importante nel meccanismo di organificazione, che porta alla produzione degli ormoni tiroidei.
Una diminuzione/assenza del funzionamento fisiologico della tiroide causata da diversi fattori intrinseci è associata a una condizione chiamata ipotiroidismo primario, mentre le condizioni che portano a un’ipofunzione dovute a lesioni a livello dell’ipotalamo e/o dell’ipofisi sono comunemente riconosciute come ipotiroidismo centrale. Il grado di compromissione della ghiandola tiroidea può essere minimo/moderato (chiamato SCH o ipotiroidismo iniziale) ed è caratterizzato da livelli circolanti di tiroxina libera (fT4) ancora entro i limiti di riferimento ma da livelli sierici elevati di TSH (più frequentemente fino a 10 mU/L). Tuttavia, la compromissione della ghiandola tiroidea può essere più grave, portando a basse concentrazioni di fT4 ed elevate concentrazioni di TSH nel siero, condizione chiamata ipotiroidismo manifesto o evidente.
L’ipotiroidismo può tradursi in diverse implicazioni cliniche a seconda dell’età di insorgenza, della gravità, del tasso di sviluppo e di alcune condizioni speciali, sia fisiologiche (gravidanza) che patologiche (specifiche comorbilità). La Tabella 1 riassume le cause dell’ipotiroidismo primario.

La prevalenza media dell’ipotiroidismo non diagnosticato e dell’ipertiroidismo non diagnosticato è stata del 4,94% (intervallo di confidenza al 95%, 4,75%–5,13%) e dell’1,72% (1,66%–1,88%), rispettivamente, con una predominanza femminile in entrambi i disordini. È importante notare che l’80,1% dei casi di malfunzionamento tiroideo non diagnosticato era di tipo subclinico. La prevalenza complessiva dell’ipertiroidismo non diagnosticato, manifesto e subclinico nelle donne è stata del 6,40%, 0,80% e 5,86%, rispettivamente, mentre negli uomini è stata rispettivamente del 3,37%, 0,30% e 3,45% [5].
Come recentemente revisionato, “Attualmente, la maggior parte delle Linee Guida redatte da società internazionali consiglia che le decisioni terapeutiche dovrebbero essere individualizzate in base all’età del paziente, al grado di aumento del TSH sierico, ai sintomi, al rischio di malattie cardiovascolari e ad altre comorbilità”. Di conseguenza, potrebbe esserci spazio per l’uso di integratori alimentari [6,7].
La maggior parte dei dati sui nutraceutici riguarda le proprietà del selenio. Il selenio ha aperto la strada in questo contesto nutraceutico, con la forma organica e più biodisponibile della L-selenometionina (SeM) che ha evidenziato risultati migliori rispetto alla forma inorganica (selenio sodico). Tuttavia, le forme organiche possono teoricamente causare accumulo di selenio, pertanto, di solito, non dovrebbe essere superata la dose giornaliera consigliata.
I membri dell’Associazione dei Medici Endocrinologi (AME) sono stati invitati a partecipare a un sondaggio online che indagava sull’uso del selenio in diverse condizioni cliniche. Tra i partecipanti, l’85,2% ha considerato l’assunzione di selenio per le malattie tiroidee (il 58,1% raramente/occasionalmente e il 27,1% spesso/sempre), e il 79,4% ha prescritto la molecola per la tiroidite autoimmune cronica (AIT) (il 39,1% a volte e il 40,3% spesso/sempre). Circa i due terzi dei partecipanti hanno considerato l’uso del selenio nei casi di SCH, e circa il 40% ha suggerito l’uso del selenio per le pazienti con AIT che stavano pianificando una gravidanza o erano già in stato di gravidanza [8,9].
Questo sondaggio nazionale ne ha suscitato uno seguente tra i membri dell’Associazione Europea della Tiroide (ETA). Una minoranza dei membri ETA che hanno risposto ha dichiarato che le evidenze disponibili giustificano l’uso del selenio nell’ipotiroidismo autoimmune, ma la maggior parte lo ha raccomandato in qualche misura, specialmente per i pazienti che non stavano ancora ricevendo L-tiroxina (LT4) [7–9].
Su queste premesse, l’uso di nutraceutici, virtualmente senza effetti collaterali e con l’obiettivo di ripristinare una condizione più fisiologica, sta guadagnando interesse, soprattutto nelle prime fasi dell’insufficienza tiroidea [10–16].
Sulla base del suo importante ruolo nella regolazione cellulare [17], il mio-inositolo (MI) può teoricamente trovare applicazione nell’ipotiroidismo subclinico (SCH) indipendentemente dall’eziologia dello SCH; infatti, esiste letteratura sull’uso del MI che può avere un effetto generico protettivo sulla tiroide, come dimostrato da dati sia in vitro che in vivo su animali. Una ricerca su PubMed utilizzando la stringa “Inositol and Hypothyroidism” ha restituito 32 articoli, la maggior parte dei quali di natura clinica e riguardanti lo SCH nell’ambito della tiroidite autoimmune cronica (AIT). Esamineremo il razionale fisiopatologico per l’uso del MI nell’AIT e in generale nello SCH, e riporteremo dati sull’uso clinico della supplementazione di MI.
Iniziando questa discussione dal possibile ruolo del MI nell’SCH correlato all’AIT, dovremmo tenere presente il ruolo del MI nell’azione del TSH [1–3,18]. Come già menzionato, dopo il legame con il suo recettore, il TSH attiva due vie. Una via coinvolge il cAMP come secondo messaggero, che ha un effetto trofico regolando la proliferazione cellulare, la differenziazione e la secrezione degli ormoni tiroidei. La seconda via, associata alle fosfolipasi C, coinvolge gli inositoli come secondi messaggeri; è principalmente implicata nella generazione di H2O2 e nell’iodinazione mediata da H2O2 di determinati residui tirosinici della tireoglobulina (Tg), sebbene sia riconosciuto ora un effetto sulle vie PI3K/Akt/mTOR. La cascata del cAMP è stimolata a basse concentrazioni di TSH, mentre la cascata degli inositoli è stimolata ad alte concentrazioni di TSH [5]. Pertanto, gli inositoli sono essenziali per la produzione degli ormoni tiroidei, cooperando con la cascata del cAMP a livello di sintesi [1,3]. Tuttavia, il ruolo degli inositoli può essere a doppio livello, poiché alcuni studi in vitro suggeriscono che l’inositolo IP3 e altri inositoli polifosfati come il 3,4,5-trifosfato sono implicati nella risposta immunitaria [19].
Per queste ragioni, la supplementazione dietetica di mio-inositolo (MI) sta guadagnando un interesse crescente, con alcuni studi originali che dimostrano che il MI può ripristinare valori normali di TSH nell’ipotiroidismo subclinico (SCH) associato all’AIT [20–22]. Naturalmente, ci sono tre punti specifici che devono essere affrontati. Il primo riguarda la possibilità che la supplementazione di MI possa avere un ruolo nell’ostacolare meccanicamente l’insorgenza e la progressione dell’SCH. Il secondo riguarda la dose ottimale e la durata di tale supplementazione. Il terzo punto riguarda la supplementazione di MI in determinate situazioni, come la gravidanza.
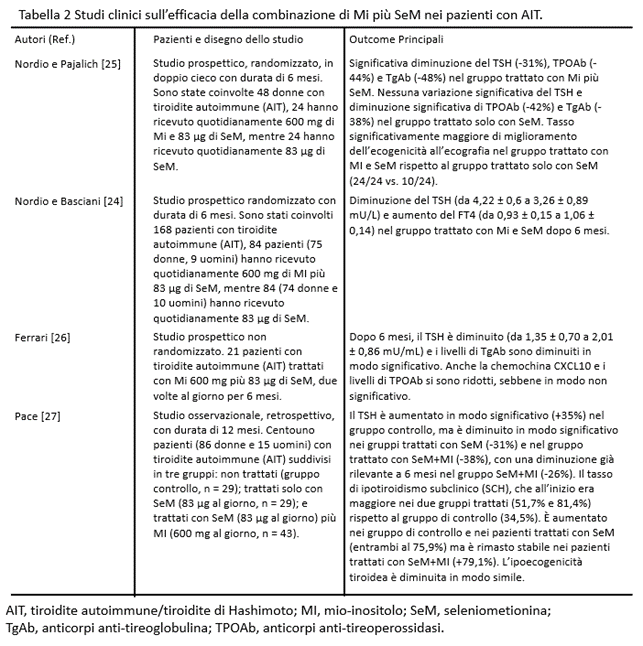
Finora, sono disponibili quattro principali studi originali, riassunti nella Tabella 2. Il primo studio [23] è uno studio prospettico randomizzato in doppio cieco. Sono state reclutate 48 donne con un’età media di 38 anni. Tutti i soggetti riscontravano l’AIT, con livelli di TSH aumentati, nell’intervallo tra 4,01 e 9,99 mU/L. Le pazienti sono state trattate o con MI più L-selenometionina (SeM) o solo con SeM. L’outcome primario era la normalizzazione dei livelli di TSH; quelli secondari erano la diminuzione dei livelli sierici di anticorpi anti-perossidasi tiroidea (AbTPO) e/o di anticorpi anti-tireoglobulina (AbTg). Le pazienti sono state randomizzate in due gruppi: un gruppo (n = 24) ha ricevuto solo SeM 83 μg per 6 mesi, mentre l’altro gruppo (n = 24) ha ricevuto SeM 83 μg e MI 600 mg per lo stesso periodo. Il TSH si è ridotto in maniera statisticamente significativa nel secondo gruppo e l’ecogenicità alla ecografia è migliorata, mentre AbTPO e AbTg sono migliorati in entrambi i gruppi.
Uno studio successivo [24] su un maggior numero di pazienti con livelli di TSH in un intervallo più ristretto ha confermato la superiorità dell’associazione MI+SeM. Nell’ultimo lavoro, sono stati arruolati 168 pazienti in uno studio prospettico randomizzato e suddivisi in due gruppi (rapporto 1:1), uno ha ricevuto SeM come nel lavoro precedente, e l’altro ha ricevuto SeM più MI. I livelli di TSH erano nell’intervallo alto della normalità o leggermente elevati (3-6 mU/L). È stata dimostrata una significativa riduzione dei livelli di TSH nel siero (oltre all’aumento del fT4) nel secondo gruppo nel corso di 6 mesi. Tuttavia, questi interessanti studi mancano di un gruppo di controllo di pazienti senza alcuna supplementazione, quindi non è del tutto chiaro se l’effetto del MI dipenda direttamente dalla somministrazione di MI stessa o derivi da un’attività sinergica con la SeM.
Il terzo studio [26] ha cercato di studiare il possibile ruolo di MI più SeM nella progressione dell’AIT in pazienti eutiroidei. Sono stati arruolati ventuno pazienti trattati con SeM più MI (83 μg/600 mg) due volte al giorno per 6 mesi. Il TSH è diminuito in tutti i pazienti, con una diminuzione più evidente nei pazienti con valori di TSH alto/normali. Gli indicatori sierici classici dell’autoimmunità tiroidea (AbTPO e AbTg) sono diminuiti.
Inoltre, in questo studio è stata valutata anche la chemochina CXCL10 (nota anche come proteina indotta da interferone gamma). La CXCL10 è diminuita, sebbene non in modo significativo. Questi risultati suggeriscono un effetto del MI più che della SeM sulla progressione dell’ipotiroidismo sia in termini di TSH che di riduzione del carico di autoimmunità. Anche in questo studio mancano gruppi di controllo con solo SeM o senza supplementazione.
I dati del terzo studio sono corroborati da uno studio in vitro degli stessi autori, che contiene non solo un gruppo di controllo, ma anche un gruppo trattato con solo MI [28]. Questo studio ha mostrato un effetto favorevole di MI, SeM o della loro combinazione sullo stress ossidativo indotto dall’acqua ossigenata sulle cellule mononucleate del sangue periferico (PBMC) dei pazienti con AIT. Come noto, l’AIT è caratterizzata da un’infiammazione linfocitica intra-tiroidea e da una sovrapproduzione di citochine, comprese le chemochine, sia da linfociti che da tireociti. Le chemochine sono state associate all’aggressività dell’AIT e, quindi, al deterioramento della funzionalità tiroidea. L’AIT è anche caratterizzata da uno stress ossidativo aumentato. Inoltre, negli esperimenti, si è supposto che le cellule mononucleate del sangue periferico riflettano i linfociti che infiltrano la tiroide. Le PBMC di donne con AIT o di controlli sono state esposte a uno stress ossidativo indotto dall’acqua ossigenata (H2O2) con l’aggiunta successiva di MI (0,25, 0,5, 1,0 μM), SeM (0,25, 0,5, 1,0 μM), o della loro combinazione (0,25+0,25, 0,5+0,5, 1,0+1,0 μM). Sia nei controlli che nelle donne con AIT, la combinazione di MI più SeM ha comportato la maggiore riduzione sia della proliferazione delle PBMC che della secrezione di tre chemochine (CXCL10/IP10, CCL2 e CXCL9/MIG) nel mezzo. Tali effetti erano dose dipendenti.
Il quarto studio [27] è stato uno studio retrospettivo in cui Pace e colleghi hanno analizzato 101 pazienti (86 donne e 15 uomini) con AIT, divisi in tre gruppi: 29 controllo (nessun trattamento), 29 trattati con SeM 83 μg e 43 trattati con SeM più MI 83 μg/600 mg una volta al giorno per 12 mesi, con misurazioni di TSH, integrate da misurazioni di fT4 e triiodotironina libera (fT3). Inoltre, è stata eseguita un’ecografia per valutare il pattern ipoecogeno. I valori di TSH sono aumentati sia a 6 che a 12 mesi nel gruppo di controllo, mentre sono diminuiti nel gruppo con SeM solo a 12 mesi e nel gruppo con MI più SeM già dai 6 mesi. La percentuale di SCH è aumentata nel gruppo di controllo e nel gruppo con SeM (sebbene non in modo significativo), mentre la percentuale di SCH è rimasta invariata nel gruppo con SeM più MI. Questo studio retrospettivo conferma i dati dei tre precedenti studi prospettici, suggerendo un ruolo sinergico di SeM più MI, sebbene sarebbe stato auspicabile avere un gruppo trattato solo con MI.
Nel complesso, tutti questi dati suggeriscono un potenziale ruolo del MI nel ripristinare l’eutiroidismo nell’AIT con SCH. Inoltre, il deterioramento della funzione tiroidea associato all’AIT sembra migliorare con il MI nell’AIT, e questo può essere un effetto favorevole sia sulle cellule tiroidee che sui linfociti. Non è del tutto chiaro se l’effetto del MI sia sinergico con la SeM, quindi si incoraggia alla realizzazione di nuovi studi. Tuttavia, il MI sembra essere un nuovo modo di affrontare l’AIT con o senza SCH, mentre è più difficile speculare sul potenziale ruolo del MI nell’SCH dovuto a cause diverse dall’AIT. Come già detto, i dati in vitro sulle cellule tiroidee umane e sugli animali evidenziano un effetto protettivo del MI, e questo suggerisce un potenziale ruolo nell’altro tipo di SCH. Alcune considerazioni patogenetiche aggiuntive potrebbero suggerire un possibile ruolo del MI da solo o associato all’iodio in aree con assunzione di iodio non ottimale [29]. Studi clinici dovrebbero essere condotti in questo contesto. A causa dell’associazione tra AIT e il cancro alla tiroide, in una sezione apposita di questo capitolo, riassumeremo l’effetto del MI da solo, della SeM da sola e del MI più SeM su CXCL10 e CCL2. La Tabella 2 riassume gli studi clinici.
La gravidanza ha un profondo impatto sulla ghiandola tiroidea. Durante la gestazione, la ghiandola tiroidea aumenta in dimensioni del 10% nei paesi ricchi di iodio, ma del 20%-40% nelle aree carenti di iodio. La produzione degli ormoni tiroidei, T4 e T3, aumenta di quasi il 50%, in concomitanza con un aumento del 50% del fabbisogno giornaliero di iodio [30]. Questi cambiamenti fisiologici supportano la crescita e lo sviluppo fetali.
Durante il primo trimestre, le donne presentano elevate concentrazioni di hCG (ormone gonadotropo corionico umano) nel siero, che sono accompagnate da livelli circolanti ridotti di TSH. L’hCG ha un’attività tireotropica e può legarsi al recettore del TSH (TSHR), a causa della loro somiglianza strutturale, stimolando così la sintesi e la secrezione degli ormoni tiroidei. A causa del feedback negativo da parte degli ormoni tiroidei sull’ipotalamo e sull’ipofisi, i livelli di TSH diminuiscono. Inoltre, durante la gestazione, si osserva un aumento delle concentrazioni sieriche della globulina legante la tiroxina (TBG), una proteina dipendente dagli estrogeni che funge da principale trasportatore plasmatico degli ormoni tiroidei, con un aumento associato delle concentrazioni totali di T3 e T4 [31]. Un altro fattore cruciale che può alterare i livelli di TSH in gravidanza è la disponibilità di iodio. Dalla prima fase della gravidanza, si segnala un aumento della clearance renale dell’iodio, in parallelo all’aumento del tasso di filtrazione glomerulare. Questo potrebbe spiegare alcuni dati epidemiologici che supportano una correlazione positiva tra i livelli di TSH e la concentrazione di iodio nelle urine. Ciò può avere un grave impatto sulla risposta della tiroide al TSH [32,33]. Gli ormoni tiroidei materni sono essenziali per il feto, soprattutto durante il primo trimestre quando dipende completamente dal loro passaggio attraverso la placenta. Pertanto, gli ormoni tiroidei materni sono particolarmente importanti per lo sviluppo neurologico del feto. Mentre la normalizzazione del TSH avviene nel secondo trimestre, i livelli di fT3 e fT4 rimangono leggermente più bassi fino al secondo e terzo trimestre. Inoltre, fino al 18% di tutte le donne in gravidanza risulta positivo agli anticorpi anti-TPO o anti-Tg. I dati suggeriscono che la positività agli anticorpi tiroidei influisce negativamente sull’impatto dello stato tiroideo sia materno che fetale. La positività agli anticorpi tiroidei aumenta in maniera indipendente il rischio di disfunzione tiroidea nel periodo post-partum [8,25,33]. Non esistono prove sufficienti per determinare in modo definitivo se la terapia con LT4 riduca il rischio di aborto nelle donne eutiroidee TPOAb-positive appena rimaste incinte. Tuttavia, l’assunzione di LT4 in donne in gravidanza eutiroidee TPOAb-positive con una precedente storia di aborto può essere presa in considerazione, data la sua potenziale efficacia rispetto ai minimi rischi associati. In tali casi, una dose iniziale tipica per il trattamento è di 25-50 μg di LT4 [25]. Per tutte queste ragioni, la valutazione accurata della funzione tiroidea materna (e fetale) durante la gravidanza rimane difficile, e l’interpretazione dei test di laboratorio differisce da quella delle pazienti non in gestazione.
Il TSH sierico è considerato l’indice biochimico più accurato dello stato tiroideo. Per quanto riguarda la diagnosi e la gestione delle malattie tiroidee in gravidanza, le Linee Guida del 2011 dell’American Thyroid Association (ATA) hanno raccomandato 2,5 μUI/mL come limite superiore del TSH normale nel primo trimestre, 3,0 μUI/mL nel secondo trimestre e 3,5 μUI/mL nel terzo trimestre. Tuttavia, le Linee Guida riviste del 2017 sempre dall’ATA suggeriscono di utilizzare i range di riferimento normativi ottenuti sulla popolazione generale [34].
L’ipotiroidismo subclinico (SCH), definito come un aumento del livello di TSH al di sopra di questi valori normali, pur mantenendo un fT4 normale, è una comune patologia tiroidea correlata alla gravidanza che colpisce dal 3% al 5% delle donne in gravidanza in tutto il mondo.
Le Linee Guida rilasciate da diverse società scientifiche, tra cui l’Endocrine Society (ES), l’American Thyroid Association (ATA) insieme all’American Association of Clinical Endocrinologists (AACE) e più recentemente dalla European Thyroid Association (ETA), concordano sulla raccomandazione che il SCH, così come l’ipotiroidismo manifesto, dovrebbe essere trattato con la sostituzione di LT4 al fine di ridurre i rischi associati durante la gravidanza per il feto. Inoltre, alcuni studi, ma non tutti, suggeriscono che il SCH potrebbe compromettere la funzione cognitiva del nascituro. Le Linee Guida [34] hanno concluso che le prove indicavano un aumento del rischio di complicazioni specifiche della gravidanza, in particolare aborto e parto pretermine, in relazione alle concentrazioni elevate di TSH materno [34]. La perdita fetale precoce si verifica naturalmente in circa il 30% delle gravidanze, e diversi studi hanno suggerito una relazione tra aborto spontaneo e livelli materni più elevati di TSH. In particolare, c’è un tasso più elevato di aborto spontaneo nelle donne con una concentrazione di TSH tra 2,5 e 5,0 mU/L rispetto a quelle con concentrazioni inferiori a 2,5 mU/L (6,1% contro 3,6%), così come un aumento del rischio di complicanze nelle donne con SCH e positività agli anticorpi anti-TPO.
Inoltre, nelle donne eutiroidee con anticorpi tiroidei positivi, i livelli di TSH aumentano progressivamente con l’avanzare della gravidanza, passando da una media di 1,7 μUI/mL nel primo trimestre a 3,5 μUI/mL nel terzo trimestre, arrivando a circa il 19% delle donne con valori di TSH al di sopra del limite superiore al momento del parto. Sembra ragionevole raccomandare o considerare il trattamento con LT4 per specifici sottogruppi di donne in gravidanza con SCH, e la forza di tale raccomandazione dovrebbe variare a seconda dello stato di anticorpi anti-TPO. Questa raccomandazione richiede anche che tutte le donne in gravidanza con una concentrazione elevata di TSH siano valutate anche per lo stato di anticorpi anti-TPO. Nel formulare questa raccomandazione, il gruppo di lavoro riconosce il rischio molto basso associato all’avvio del trattamento con basse dosi di LT4. Di solito, una dose di soli 50 μg al giorno è necessaria per un trattamento efficace delle donne con SCH [34].
Inoltre, anche le tempistiche con cui si inizia la terapia potrebbero svolgere un ruolo importante nell’efficacia della terapia stessa. I dati, infatti, dimostrano una riduzione complessiva del tasso di complicanze della gravidanza nelle donne trattate nel primo trimestre, ma non in quelle trattate nel secondo trimestre, e una riduzione del tasso delle nascite premature nelle donne che hanno iniziato il trattamento subito dopo la prima visita prenatale.
Si dovrebbe prestare particolare attenzione anche alle donne eutiroidee con anticorpi tiroidei positivi, poiché in queste donne i valori di TSH aumentano progressivamente con l’avanzare della gravidanza, arrivando a circa il 19% delle donne con valori di TSH al di sopra del limite superiore al momento del parto. Tali donne potrebbero diventare il bersaglio di terapie non farmacologiche mirate a mantenere l’eutiroidismo durante la gravidanza [35,36].
Come indicato in precedenza, numerose pubblicazioni hanno dimostrato gli effetti benefici del trattamento con MI (mio-inositolo) e SeM (selenometionina) nei confronti dell’SCH (ipotiroidismo subclinico) e dell’AIT (tiroidite autoimmune), sia in vitro che in vivo. Pertanto, la supplementazione di MI in gravidanza potrebbe essere presa in considerazione per prevenire o trattare l’SCH [16,37].
Il MI, come ampiamente già indicato, è coinvolto nella segnalazione cellulare e, come secondo messaggero, regola l’attività dell’TSH e di altri ormoni come l’ormone follicolo-stimolante (FSH) e l’insulina [17,36,38].
Sembra che l’aumento dell’abbondanza cellulare di MI migliori la sensibilità del TSH delle cellule follicolari della tiroide. Pertanto, ciò potrebbe spiegare l’effetto del MI nel mantenere i livelli di TSH a valori normali durante l’intera gravidanza delle pazienti.
Nel 2018, Porcaro e Angelozzi hanno dimostrato l’efficacia e la sicurezza della supplementazione di MI e SeM in donne eutiroidee in gravidanza [39,40]. Lo studio ha coinvolto donne tra i 18 e i 40 anni, con un indice di massa corporea tra 19 e 25 kg/m2, una singola gravidanza intrauterina e livelli di TSH compresi tra 1,6 e 2,5 μUI/mL. Sono state escluse le donne con funzione tiroidea anomala, una storia di aborto spontaneo o parto prematuro, e le donne con obesità o che stavano seguendo qualsiasi tipo di trattamento antitiroideo.
È stata condotto uno studio prospettico su donne in gravidanza, dal primo trimestre fino al parto. Sono stati effettuati controlli di TSH, fT3 e fT4 nel primo, secondo e terzo trimestre (T0, T1 e T2). Le donne sono state suddivise in due gruppi: il gruppo A (n = 17) è stato trattato con 600 mg di MI (mio-inositolo) e 83 μg di Se (selenio) fino al parto, mentre il gruppo B (n = 16) non ha ricevuto alcun trattamento. Il trattamento è iniziato alla decima settimana di gestazione ed è proseguito fino alla fine della gravidanza. L’obiettivo principale era il mantenimento dei livelli normali di TSH durante l’intera gravidanza. Gli obiettivi secondari includevano il mantenimento dei livelli normali di fT3 (2,57-4,43 pg/mL) e fT4 (0,93-1,70 ng/dL) durante l’intera gravidanza. I risultati hanno dimostrato una prevenzione dell’SCH grazie al trattamento (gruppo A), con una stabilizzazione di TSH, fT3 e fT4. I livelli di TSH sono rimasti praticamente invariati nel gruppo trattato durante tutta la gravidanza. In questo gruppo è stato registrato un unico caso di abbandono perché i livelli di TSH sono saliti fino a 3,00 μIU/ml nel secondo trimestre, e la paziente ha iniziato il trattamento con LT4. Tutte le altre 16 pazienti hanno continuato il trattamento con la combinazione delle due sostanze fino al parto. Nel gruppo di controllo (gruppo B), sono stati osservati 3 casi di abbandono nel secondo trimestre, e altre 2 pazienti hanno avuto livelli elevati di TSH nel terzo trimestre, tali da iniziare il trattamento con L-T4. Questo studio ha evidenziato che i valori normali degli ormoni tiroidei sono stati mantenuti nel 94,1% delle donne in gravidanza nel gruppo trattato, rispetto al 68,7% nel gruppo di controllo, con una differenza statisticamente significativa. Questi risultati sono perfettamente in linea con le evidenze cliniche precedenti che hanno messo in risalto l’effetto benefico della supplementazione di MI e SeM nel ripristinare lo stato eutiroideo nelle pazienti con diagnosi di SCH [39,40].
Chiaramente, la sicurezza del MI (mio-inositolo) in gravidanza è stata confermata da questo studio e da diversi studi condotti sull’uso del MI nel diabete gestazionale e nella prevenzione della spina bifida, nonostante il fatto che il MI fosse già ampiamente utilizzato in altre patologie legate alla gravidanza [13,41].
La supplementazione di MI più SeM sembra prevenire le fluttuazioni degli ormoni tiroidei, mantenendo uno stato eutiroideo in quasi tutte le donne in gravidanza, in modo che il MI più SeM potrebbe aiutare le donne in gravidanza a evitare complicanze materno-fetali legate alla possibile insorgenza di SCH (ipotiroidismo subclinico) [41]. Il ruolo del MI più SeM nelle pazienti in gravidanza con AIT (tiroidite autoimmune) o SCH dovrebbe essere confermato, anche se tali studi di conferma sarebbero ostacolati da preoccupazioni etiche, perché nelle donne in gravidanza con SCH, il trattamento con LT4 è obbligatorio [1,3,13]. Tuttavia, il MI potrebbe essere di particolare interesse in tutti i casi in cui il TSH appare normale all’inizio della gravidanza, ma ci possono essere alcune preoccupazioni minori riguardo a un possibile sviluppo di SCH.
Nello specifico, l’attuale panorama dei risultati clinici riportati nella letteratura rivela che la supplementazione di MI più SeM è utile per gestire le condizioni di SCH. Dati incoraggianti provenienti dagli studi su questo nutraceutico e le malattie tiroidee sostengono l’uso del MI per prevenire lo sviluppo di SCH in gravidanza.
Il cancro alla tiroide è il cancro endocrino più comune, e la sua incidenza sta aumentando in tutto il mondo, anche nella popolazione pediatrica. Non è lo scopo di questo lavoro discutere tutti i fattori di rischio per il cancro alla tiroide, ma due punti dovrebbero essere presi in considerazione [42-47].
Il primo punto è che l’AIT (tiroidite autoimmune) potrebbe predisporre al cancro differenziato della tiroide, in particolare al suo principale istotipo (il cancro alla tiroide papillare [PTC]). Al contrario, è ben nota l’associazione tra l’AIT e il raro linfoma della tiroide [45,48-51].
Il secondo punto riguarda il possibile ruolo che i livelli aumentati di TSH nel siero possono avere nel favorire il cancro alla tiroide. Una metanalisi [52] ha coinvolto 28 studi, un totale di 42.032 soggetti sani e 5.786 casi di cancro alla tiroide. Per livelli di TSH inferiori a 1,0 mU/L, l’odds ratio (OR) per il cancro alla tiroide era di 1,16 per milliunità per litro. Gli studi che controllavano l’autoimmunità riportavano l’OR più basso (TSH inferiore a 2,5 mU/L, OR 1,23 per milliunità per litro; TSH di 2,5 mU/L o superiore, OR 0,98 per milliunità per litro). La metanalisi ha concluso che concentrazioni più elevate di TSH nel siero sono associate a un aumentato rischio di cancro alla tiroide e che l’autoimmunità tiroidea potrebbe spiegare in parte l’associazione [53-55].
Anche se intriganti, secondo noi, questi ultimi dati presentano una scarsa giustificazione teorica, poiché nell’AIT, la predisposizione al cancro papillare sembra più correlata alla stessa condizione di AIT rispetto ai livelli elevati di TSH. Tuttavia, il ruolo protettivo del MI nella progressione dell’AIT potrebbe rappresentare un beneficio [56,57].
Le prove che l’AIT sia un fattore di rischio per il cancro midollare della tiroide sono più limitate e basate principalmente su segnalazioni di casi.
La Tabella 3 riporta una breve classificazione del cancro e dei tumori alla tiroide, in linea con la classificazione dell’OMS.
La patogenesi del cancro alla tiroide si inserisce nel meccanismo generale complesso delle neoplasie, che implica uno stimolo alla proliferazione e un blocco dell’apoptosi e della senescenza, nel contesto di molteplici mutazioni genetiche e fattori epigenetici che possono essere sia la causa che l’effetto [58].

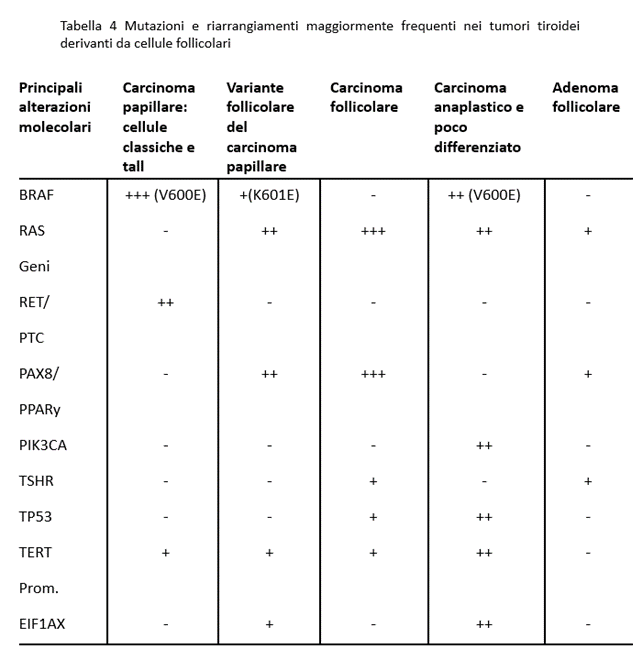
La Tabella 4 riporta i principali oncogeni e geni oncosoppressori le cui mutazioni sono implicati nella tiroide. Tuttavia, i ruoli di queste mutazioni non sono completamente compresi. La mutazione più studiata è quella del BRAF-V600E, la cui importanza come mutazione cruciale nella aggressività del cancro è ancora oggetto di dibattito. Al contrario, una cattiva prognosi potrebbe derivare dalla contemporanea presenza delle mutazioni del BRAF-V600E e del promotore del TERT.
Oltre alle mutazioni dei geni RAS e delle mutazioni BRAF V600E, che sono mutualmente esclusive, alcuni oncogeni delle vie MAPK e PI3K/AKT possono cooperare nella tumorigenesi. Quindi, potrebbe esserci spazio per l’uso del MI.
Infatti, alcuni studi hanno mostrato un potenziale beneficio del MI nell’ambito dell’oncologia [17,60]. Nel complesso, il ruolo del MI può essere a diversi livelli. Il MI e in particolare la sua forma di esofosfato (MIP6) possono avere un’ampia attività anticancro. In particolare, questi composti mostrano effetti a diversi livelli: (1) induzione dell’arresto nella fase G1 e inibizione selettiva nella fase S nelle cellule tumorali; (2) inibizione della via PI3K/AKT; (3) effetto anticancro indiretto mediante la modulazione dell’attività dell’insulina; e (4) effetto antiossidante. In particolare, l’effetto sulla via PI3K/AKT potrebbe anche funzionare per contrastare l’attivazione della cascata che coinvolge altri oncogeni.
Fino ad oggi, la maggior parte dei dati in vitro e in vivo è concentrata sul cancro del colon e il cancro al seno, nei quali il MI è stato utile anche nel migliorare gli effetti collaterali e la qualità della vita dei pazienti sottoposti a chemioterapia.
Sebbene le premesse teoriche sopra menzionate sembrino promettenti, mancano studi clinici a sostegno dell’uso del MI nel cancro alla tiroide. Tuttavia, è degno di nota un interessante studio [29] su noduli tiroidei a basso/intermedio rischio di malignità all’ecografia. Questo studio retrospettivo ha arruolato pazienti con SCH (ipotiroidismo subclinico) o livelli borderline elevati di TSH insieme a noduli tiroidei classificati come classe I e/o II secondo le Linee Guida AACE, ACE, AME. In queste Linee Guida, la classe I indica noduli a basso rischio, e la classe II indica noduli a rischio intermedio. Il gruppo in trattamento era composto da 18 pazienti che hanno ricevuto MI più SeM (600 mg/83 μg) una volta al giorno per 6 mesi, mentre il gruppo controllo da 16 pazienti, nei quali non è stato impiegato alcun trattamento. I due gruppi erano comparabili per livelli sierici di TSH, dimensioni dei noduli, età e BMI. Il punto principale di riferimento era la dimensione del nodulo, mentre i punti secondari di riferimento includevano i valori di TSH, il numero di noduli, il punteggio di elasticità, la presenza di calcificazioni e la vascolarizzazione. Dopo 6 mesi, le dimensioni dei noduli, il numero totale di noduli e il punteggio di elasticità sono diminuiti in modo significativo, così come i valori sierici di TSH.
Una limitazione di questo studio è che non possiamo dedurre se la diminuzione delle dimensioni e del numero dei noduli sia dovuta a un effetto diretto di MI più SeM sulla crescita o se sia un effetto indiretto, mediato dalla diminuzione del TSH sierico. Tuttavia, poiché la diminuzione del TSH è stata lieve (<1,0 mU/L), sebbene statisticamente significativa, sembra più probabile un effetto diretto sulla crescita dei noduli tiroidei. Sono incoraggiate ulteriori ricerche sulle azioni del MI su noduli tiroidei e cancro. Fino ad oggi, possiamo dire che l'uso di MI più SeM sembra avere un'azione teoricamente forte come agente antiproliferativo a livello tiroideo, senza causare effetti collaterali significativi. In questa sezione, è pertinente ricordare lo studio sperimentale sui topi trattati con cadmio. Infatti, il cadmio è considerato un cancerogeno con un'associazione potenziale confermata con diverse neoplasie [61,62]. Per quanto riguarda il cancro alla tiroide, uno studio su 66 pazienti con carcinoma tiroideo papillare (PTC) ha mostrato come il contenuto di cadmio era significativamente aumentato mentre il contenuto di selenio era significativamente diminuito nel tessuto canceroso rispetto al tessuto tiroideo non canceroso. Anche il contenuto di MI in diversi tumori è risultato diminuito rispetto al tessuto non tumorale, e molto più ridotto nei tumori ad alto grado di malignità rispetto a quelli a basso grado. Per quanto riguarda il cancro alla tiroide, uno studio in vivo su topi basato sulla spettroscopia a risonanza magnetica nucleare ad alto angolo di rotazione (1H HR MAS NMR) ha valutato le caratteristiche metaboliche di 38 lesioni maligne (tutte PTC), 32 lesioni benigne e 112 campioni di tessuto non tumorale. Tra gli altri dati, il contenuto di MI era significativamente più basso nei noduli maligni rispetto ai noduli benigni. A sua volta, i livelli intra-tumorali di MI erano inferiori rispetto al tessuto non tumorale [41,63]. Tornando alla nostra ricerca sperimentale, distinti gruppi di topi maschi sono stati alimentati per 14 giorni con soluzione fisiologica o cloruro di cadmio (CdCl2, 2 mg/kg/giorno), o CdCl2 più integratori alimentari. Gli integratori alimentari somministrati insieme a CdCl2 erano di cinque tipi: SeM (0,2 mg/kg/giorno), SeM (0,4 mg/kg/giorno), MI (360 mg/kg/giorno), MI+SeM (0,2 mg/kg/giorno) e MI+SeM (0,4 mg/kg/giorno). Dopo il sacrificio, le tiroidi sono state valutate istologicamente e immunoistochimicamente. Il CdCl2 ha causato diverse alterazioni tiroidee, riducendo l'area follicolare, aumentando l'altezza epiteliale, lo stroma e potenziando le cellule che esprimevano la chemochina CXCL10 e la chemochina CCL2 (nota anche come proteina monocitaria chemoattrattiva-1 [MCP-1]). La formulazione nutraceutica più efficace nel contrastare l'effetto della co-somministrazione di CdCl2, in grado di rendere le tiroidi comparabili a quelle dei topi non trattati con CdCl2, è stata l'associazione di MI (360 mg/kg/giorno) + SeM (0,4 mg/kg/giorno). Il MI da solo è stato più efficace rispetto a ciascuna dose di SeM da solo [12,61]. La contromisura contro l'aumento indotto dal CdCl2 dell'espressione delle chemochine è rilevante perché le chemochine possono modulare direttamente la crescita dei tumori, inducendo la proliferazione delle cellule tumorali e impedendo la loro apoptosi. Inoltre, le chemochine guidano anche il movimento delle cellule tumorali richiesto per le metastasi. Come esempi illustrativi per le chemochine CCL2 e CXCL10 nel cancro alla tiroide, l'attivazione oncogenica di BRAF nelle tiroidi murine ha aumentato l'espressione di CCL2, e i riarrangiamenti oncogenici RET/PTC e/o le mutazioni attivanti dei geni oncogeni BRAF e RAS nelle cellule di carcinoma tiroideo papillare (PTC) attivano un programma trascrizionale che include l'upregulation di CXCL10. Riguardo allo studio murino che esamina le cellule tiroidee che esprimono la calcitonina (CT), è stata utilizzata la stessa metodologia descritta nello studio precedente sulle cellule follicolari. Rispetto al veicolo, il CdCl2 ha aumentato significativamente il numero di cellule positive alla CT, l'area e la densità citoplasmatica e ha causato la scomparsa delle cellule CT che subivano l'apoptosi. Confermando i dati sulla parte follicolare della tiroide, il nutraceutico più efficace che ha contrastato tutti quei cambiamenti indotti dal CdCl2, in grado di rendere la parte neuroendocrina della tiroide simile a quella dei topi non trattati con CdCl2, è stato il MI (360 mg/kg/giorno) + SeM (0,4 mg/kg/giorno). Il MI da solo è stato più efficace rispetto a ciascuna dose di SeM da solo. Pertanto, l'associazione di MI più SeM è efficace nella protezione della tiroide del topo dall'iperplasia e dall'ipertrofia delle cellule C indotte dal cadmio (e forse dall'iperplasia/ipertrofia dovuta ad altre cause). L'applicazione traslazionale potrebbe essere la possibile prevenzione, ritardamento e/o riduzione del comportamento aggressivo della malignità nei parenti dei pazienti con carcinoma midollare tiroideo familiare, la malignità tiroidea che origina dalle cellule CT [12]. In breve, non sorprende che il MIP6 e il suo composto principale MI stiano attirando molta attenzione per il loro ruolo nella prevenzione del cancro e nel controllo della crescita, della progressione e delle metastasi tumorali, con la loro azione anticancro che è stata dimostrata in diversi modelli sperimentali per stimolare gli studi clinici.[/et_pb_text][et_pb_text _builder_version="4.20.4" _module_preset="default" global_colors_info="{}"]Conclusioni
Il MI ha una profonda influenza sulla regolazione e sulla proliferazione delle cellule tiroidee. La supplementazione di MI più SeM ha una solida giustificazione, con studi originali che confermano la sua sicurezza e il suo effetto sia nel ripristinare i livelli normali di TSH sia nell’ostacolare la progressione dallo SCH all’ipotiroidismo manifesto nell’AIT. Il ruolo nel cancro alla tiroide dovrà essere ulteriormente indagato, ma i dati sui noduli tiroidei sembrano promettenti. Anche gli studi sugli animali suggeriscono un effetto protettivo del MI direttamente contro la proliferazione del cancro e indirettamente mediante l’inibizione della secrezione di chemochine.
Un punto su cui concentrarsi sarà il ruolo del MI da solo o il ruolo di SeM più MI. Per quanto riguarda la dose di MI di 600 mg, sembra essere sufficiente per ottenere risultati clinici, ma naturalmente potrebbero essere indagate diverse dosi, così come dovrebbe essere indagato se l’effetto potrebbe dipendere dall’assunzione “basale” di MI nei soggetti trattati, ovvero l’apporto dietetico specifico della popolazione studiata.
[1] Berridge MJ, Irvine RF. Inositol phosphates and cell signaling. Nature 1989;341:197–205.
[2] Corvilain B, Laurent E, Lecomte M, Vansande J, Dumont JE. Role of the cyclic adenosine 3’,5-monophosphate and the phosphatidylinositol-Ca2+ cascades in mediating the effects of thyrotropin and iodide on hormone synthesis and secretion in human thyroid slices. J Clin Endocrinol Metab 1994;79:152–9.
[3] Goel R, Raju R, Maharudraiah J, Sameer Kumar GS, Ghosh K, Kumar A, et al. A signaling network of thyroid-stimulating hormone. J Proteomics Bioinform 2011;4. https://doi.org/10.4172/jpb.1000195.
[4] Dinicola S, Unfer V, Facchinetti F, Soulage CO, Greene ND, Bizzarri M, Lagana` AS, Chan SY, Bevilacqua A, Pkhaladze L, Benvenga S, Stringaro A, Barbaro D, Appetecchia M, Aragona C, Bezerra Espinola MS, Cantelmi T, Cavalli P, Chiu TT, Copp AJ, D’Anna R, Dewailly D, Di Lorenzo C, Diamanti-Kandarakis E, Hernandez Marı´n I, Hod M, Kamenov Z, Kandaraki E, Monastra G, Montanino Oliva M, Nestler JE, Nordio M, Ozay AC, Papalou O, Porcaro G, Prapas N, Roseff S, Vazquez-Levin M, Vucenik I, Wdowiak A. Int J Mol Sci 2021;22(19):10575.
[5] Garmendia Madariaga A, Santos Palacios S, Guillen-Grima F, Galofre JC. The incidence and prevalence
of thyroid dysfunction in Europe: a meta-analysis. J Clin Endocrinol Metab 2014;99(3):923–31.
[6] Duntas LH, Benvenga S. Selenium: an element for life. Endocrine 2015;48(3):756–75.
[7] Ventura M, Melo M, Carrilho F. Selenium and thyroid disease: from pathophysiology to treatment. Int J Endocrinol 2017;2017:1297658.
[8] Negro R, Attanasio R, Grimaldi F, Marcocci C, Guglielmi R, Papini E. A 2016 Italian survey about the clinical use of selenium in thyroid disease. Eur Thyroid J 2016;5(3):164–70.
[9] Winther KH, Papini E, Attanasio R, Negro R, Hegedus L. A 2018 European Thyroid Association survey on the use of selenium supplementation in Hashimoto’s thyroiditis. Eur Thyroid J 2020;9 (2):99–105.
[10] Benvenga S, Feldt-Rasmussen U, Bonofiglio D, Asamoah E. Nutraceutical supplements in the thyroid setting: health benefits beyond basic nutrition. Nutrients 2019;11:2214.
[11] Benvenga S, Ferrari SM, Elia G, Ragusa F, Patrizio A, Paparo SR, Camastra S, Bonofiglio D, Antonelli A, Fallahi P. Nutraceuticals in thyroidology: a review of in vitro, and in vivo animal studies. Nutrients 2020;12:1337.
[12] Benvenga S, Micali A, Ieni A, Antonelli A, Fallahi P, Pallio G, Irrera N, Squadrito F, Picciolo G, Puzzolo D, Minutoli L. The association of myo-inositol and selenium contrasts cadmium-induced thyroid C cell hyperplasia and hypertrophy in mice. Front Endocrinol (Lausanne) 2021;12, 608697.
[13] Carlomagno G, Unfer V. Inositol safety: clinical evidences. Eur Rev Med Pharmacol Sci 2011;15:931–6.
[14] Duntas LH, Mantzou E, Koutras DA. Effects of a six-month treatment with selenomethionine in patients with autoimmune thyroiditis. Eur J Endocrinol 2003;148:389–93.
[15] Gartner R, Gasnier BC, Dietrich JW, Krebs B, Angstwurm MW.Selenium supplementation in patients with autoimmune thyroiditis decreases thyroid peroxidase antibodies concentrations. J Clin Endocrinol Metab 2002;87:1687–91.
[16] Mazokopakis EE, Papadakis JA, Papadomanolaki MG, Batistakis AG, Giannakopoulos TG, Protopapadakis EE, Ganotakis ES. Effects of 12months treatment with L-selenomethionine on serum anti-TPO levels in patients with Hashimoto’s thyroiditis. Thyroid 2007;17:609–12.
[17] Bizzarri M, Dinicola S, Bevilacqua A, Cucina A. Broad spectrum anticancer activity of myo-inositol and inositol hexakisphosphate. Int J Endocrinol 2016;2016:5616807.
[18] Szabo´ J, Foris G, Keresztes T, Csabina S, Varga Z, Bako´ G, Mezo˜ si E, Nagy E, Paragh G, Le€ovey A. Heterogeneous signal pathways through TSH receptors in porcine thyroid cells following stimulation with Graves’ immunoglobulin G. Eur J Endocrinol 1998;139(3):355–8.
[19] Benvenga S, Antonelli A. Inositol(s) in thyroid function, growth and autoimmunity. Rev Endocr Metab Disord 2016;17(4):471–84.
[20] Benvenga S, Vicchio T, Di Bari F, Vita R, Fallahi P, Ferrari SM, Catania S, Costa C, Antonelli A. Favorable effects of myo-inositol, selenomethionine or their combination on the hydrogen peroxide-induced oxidative stress of peripheral blood mononuclear cells from patients with Hashimoto’s thyroiditis: preliminary in vitro studies. Eur Rev Med Pharmacol Sci 2017;21(2 Suppl):89–101.
[21] Caturegli P, De Remigis A, Chuang K, Dembele M, Iwama A, Iwama S. Hashimoto’s thyroiditis: celebrating the centennial through the lens of the Johns Hopkins hospital surgical pathology records. Thyroid 2013;23(2):142–50.
[22] Fallahi P, Ferrari SM, Elia G, Ragusa F, Paparo SR, Caruso C, Guglielmi G, Antonelli A. Myo-inositol in autoimmune thyroiditis, and hypothyroidism. Rev Endocr Metab Disord 2018;19(4):349–54.
[23] Nordio M, Basciani S. Treatment with myo-inositol and selenium ensures euthyroidism in patients with autoimmune thyroiditis. Int J Endocrinol 2017;2017:2549491.
[24] Nordio M, Basciani S. Myo-inositol plus selenium supplementation restores euthyroid state in Hashimoto’s patients with subclinical hypothyroidism. Eur Rev Med Pharmacol Sci 2017;21:51–9.
[25] Nordio M, Pajalich R. Combined treatment with myo-inositol and selenium ensures euthyroidism in subclinical hypothyroidism patients with autoimmune thyroiditis. J Thyroid Res 2013;2013, 424163.
[26] Ferrari SM, Fallahi P, Di Bari F, Vita R, Benvenga S, Antonelli A. Myo-inositol and selenium reduce the risk of developing overt hypothyroidism in patients with autoimmune thyroiditis. Eur Rev Med Pharmacol Sci 2017;21:36.
[27] Pace C, Tumino D, Russo M, Le Moli R, Naselli A, Borzı` G, Malandrino P, Frasca F. Role of selenium and myo-inositol supplementation on autoimmune thyroiditis progression. Endocr J 2020;67 (11):1093–8.
[28] Ferrari SM, Elia G, Ragusa F, Paparo SR, Caruso C, Benvenga S, Fallahi P, Antonelli A. The protective effect of myo-inositol on human thyrocytes. Rev Endocr Metab Disord 2018;19(4):355–62.
[29] Barbaro D, Incensati RM,Materazzi G, Boni G, Grosso M, Panicucci E, Lapi P, Pasquini C, Miccoli P. The BRAF V600E mutation in papillary thyroid cancer with positive or suspected pre-surgical cytological finding is not associated with advanced stages or worse prognosis. Endocrine 2014;45 (3):462–8.
[30] Stagnaro-Green A, Abalovich M, Alexander E, Azizi F, Mestman J, Negro R, Nixon A, Pearce EN, Soldin OP, Sullivan S, Wiersinga W. Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and postpartum. Thyroid 2011;21:1081–125.
[31] Glinoer D. The regulation of thyroid function in pregnancy: pathways of endocrine adaptation from physiology to pathology. Endocr Rev 1997;18:404–33.
[32] Glinoer D, de Nayer P, Bourdoux P, Lemone M, Robyn C, van Steirteghem A, Kinthaert J, Lejeune B. Regulation of maternal thyroid during pregnancy. J Clin Endocrinol Metab 1990;71:276–87.
[33] Glinoer D, De Nayer P, Robyn C, Lejeune B, Kinthaert J, Meuris S. Serum levels of intact human chorionic gonadotropin (HCG) and its free alpha and beta subunits, in relation to maternal thyroid stimulation during normal pregnancy. J Endocrinol Investig 1993;16:881–8.
[34] Alexander EK, Pearce EN, Brent GA, Brown RS, Chen H, Dosiou C, et al. 2017 Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and the postpartum. Thyroid 2017;27(3):315–89.
[35] Barbaro D, Orru` B, Unfer V. Iodine and myo-inositol: a novel promising combination for iodine deficiency. Front Endocrinol 2019;10. art 457.
[36] Unfer V, Orru B, Monastra G. Inositols: from physiology to rational therapy in gynecological clinical practice. Expert Opin Drug Metab Toxicol 2016;12:1129–31.
[37] Nordio M, Basciani S. Evaluation of thyroid nodule characteristics in subclinical hypothyroid patients under a myo-inositol plus selenium treatment. Eur Rev Med Pharmacol Sci 2018;22(7):2153–9.
[38] Bizzarri M, Fuso A, Dinicola S, Cucina A, Bevilacqua A. Pharmacodynamics and pharmacokinetics of inositol(s) in health and disease. Expert Opin Drug Metab Toxicol 2016;12:1181–96.
[39] Porcaro G, Angelozzi P. Myo-inositol and selenium prevent subclinical hypothyroidism during pregnancy: an observational study. IJMDAT 2018;1(2), e164.
[40] Porcaro G, Angelozzi P. Preventing subclinical hypothyroidism during pregnancy: promising data from
a singular case. IJMDAT 2018;1, e106.
[41] Benvenga S, Nordio M, Lagana` AS, Unfer V. The role of inositol in thyroid physiology and in subclinical
hypothyroidism management. Front Endocrinol 2021;12:662582.
[42] Chatchomchuan W, Thewjitcharoen Y, Karndumri K, Porramatikul S, Krittiyawong S, Wanothayaroj
E, Vongterapak S, Butadej S, Veerasomboonsin V, Kanchanapitak A, Rajatanavin R, Himathongkam
T. Recurrence factors and characteristic trends of papillary thyroid cancer over three decades. Int J Endocrinol 2021;2021:9989757.
[43] Deng Y, Li H, Wang M, Li N, Tian T, Wu Y, Xu P, Yang S, Zhai Z, Zhou L, Hao Q, Song D, Jin T, Lyu J, Dai Z. Global burden of thyroid cancer from 1990 to 2017. JAMA Netw Open 2020;3(6), e208759.
[44] Papendieck P, Grun˜eiro-Papendieck L, Venara M, Acha O, Cozzani H, Mateos F, Maglio S, Calcagno ML, Bergada I, Chiesa A. Differentiated thyroid cancer in children: prevalence and predictors in a large cohort with thyroid nodules followed prospectively. J Pediatr 2015;167(1):199–201.
[45] Penta L, Cofini M, Lanciotti L, Leonardi A, Principi N, Esposito S. Hashimoto’s disease and thyroid cancer in children: are they associated? Front Endocrinol (Lausanne) 2018;9:565.
[46] Vaccarella S, Franceschi S, Bray F, Wild CP, Plummer M, Dal Maso L. Worldwide thyroid-cancer epidemic? The increasing impact of overdiagnosis. N Engl J Med 2016;375(7):614–7.
[47] Vigneri R, Malandrino P, Russo M. Is thyroid cancer increasing in incidence and aggressiveness? J Clin Endocrinol Metab 2020;105(7).
[48] Benvenga S, Trimarchi F. Changed presentation of Hashimoto’s thyroiditis in north-eastern Sicily and Calabria (Southern Italy) based on a 31-year experience. Thyroid 2008;18:429e41.
[49] Pavlidis ET, Pavlidis TE. A review of primary thyroid lymphoma: molecular factors, diagnosis and management. J Investig Surg 2019;32(2):137–42.
[50] Sur ML, Gaga R, Laza˘r C, Lazea C, Aldea C, Sur D. Papillary thyroid carcinoma in children with Hashimoto’s thyroiditis—a review of the literature between 2000 and 2020. J Pediatr Endocrinol Metab 2020;33(12):1511–7.
[51] Travaglino A, Pace M, Varricchio S, Insabato L, Giordano C, Picardi M, Pane F, Staibano S, Mascolo M. Hashimoto thyroiditis in primary thyroid non-Hodgkin lymphoma. Am J Clin Pathol 2020;153 (2):156–64.
[52] McLeod DS, Watters KF, Carpenter AD, Ladenson PW, Cooper DS, Ding EL. Thyrotropin and thyroid cancer diagnosis: a systematic review and dose-response meta-analysis. J Clin Endocrinol Metab 2012;97:2682–92.
[53] Bai Y, Kakudo K, Jung CK. Updates in the pathologic classification of thyroid neoplasms: a review of the World Health Organization Classification. Endocrinol Metab (Seoul) 2020;35(4):696–715.
[54] Boelaert K, Horacek J, Holder RL, Watkinson JC, Sheppard MC, Franklyn JA. Serum thyrotropin
concentration as a novel predictor of malignancy in thyroid nodules investigated by fine-needle aspiration.
J Clin Endocrinol Metab 2006;91:4295–301.
[55] Golbert L, de Cristo AP, Faccin CS, Farenzena M, Folgierini H, Graudenz MS, Maia AL. Serum TSH levels as a predictor of malignancy in thyroid nodules: a prospective study. PLoS One 2017;12, e0188123.
[56] Dasgupta S, Chakrabarti S, Mandal PK, Das S. Hashimoto’s thyroiditis and medullary carcinoma of thyroid. JNMA J Nepal Med Assoc 2014;52(194):831–3.
[57] Malpani S, Tandon A, Panwar H, Khurana U, Kapoor N, Behera G, Gupta V. Medullary thyroid carcinoma co-existent with Hashimoto’s thyroiditis diagnosed by a comprehensive cytological approach. Diagn Cytopathol 2020;48(4):386–9.
[58] Benvenga S, Antonelli A, Vita R. Thyroid nodules and thyroid autoimmunity in the context of environmental pollution. Rev Endocr Metab Disord 2015;16:319e40.
[59] Moulana FI, Priyani AAH, de Silva MVC, Dassanayake RS. BRAF-oncogene-induced senescence and the role of thyroid-stimulating hormone signaling in the progression of papillary thyroid carcinoma. Horm Cancer 2018;9(1):1–11.
[60] Chu YD, Yeh CT. The molecular function and clinical role of thyroid stimulating hormone receptor in cancer cells. Cells 2020;9(7):1730.
[61] Benvenga S, Marini HR, Micali A, Freni J, Pallio G, Irrera N, Squadrito F, Altavilla D, Antonelli A, Ferrari SM, Fallahi P, Puzzolo D, Minutoli L. Protective effects of myo-inositol and selenium on cadmium-induced thyroid toxicity in mice. Nutrients 2020;12(5):1222.
[62] Stojsavljević A, Rovčanin B, Krstić D, Jagodić J, Borković-Mitic S, Paunović I, Živaljevic V, Mitić B, Gavrović-Jankulović M, Manojlović D. Cadmium as main endocrine disruptor in papillary thyroid carcinoma and the significance of Cd/Se ratio for thyroid tissue pathophysiology. J Trace Elem Med Biol
2019;55:190–5.
[63] Benvenga S, Elia G, Ragusa F, Paparo SR, Sturniolo MM, Ferrari SM, Antonelli A, Fallahi P. Endocrine disruptors and thyroid autoimmunity. Best Pract Res Clin Endocrinol Metab 2020;34(1):101377.
Articoli in evidenza
Mastalgia ciclica e non: quali rimedi?
La mastalgia è una condizione provata da quasi tutte le donne almeno una volta nella vita. Si manifesta principalmente come dolore a una o entrambe le mammelle, pesantezza e aumentata sensibilità.
Anemia sideropenica: come contrastarla
L’anemia sideropenica è una forma di anemia causata dalla carenza di ferro nell’organismo. Il ferro svolge molti ruoli nell’organismo ed è un elemento essenziale per la nostra vita. Il ferro non è solo un componente funzionale dell’emoglobina, la proteina che trasporta l’ossigeno, ma è necessario anche per assicurare il funzionamento di importanti vie metaboliche, tra cui la respirazione cellulare.
Papilloma Virus: cos’è l’HPV, diagnosi e terapie
L’infezione da HPV è l’infezione sessualmente trasmessa più diffusa nei paesi sviluppati. I papilloma virus (dal latino “papilla”, pustola e dal greco “oma”, tumore) appartengono alla famiglia dei papillomaviridae, di cui sono noti più di 200 tipi. Il Papilloma Virus Umano (HPV, Human Papilloma Virus) è responsabile, nella maggior parte dei casi, di lesioni benigne, come le verruche o i condilomi, che colpiscono le mucose genitali e orali.