Evanthia Diamanti-Kandarakis a, Olga Papaloub b eChristophe O. Soulagec c,d
a Dipartimento di Endocrinologia e Diabete, professoressa di Endocrinologia, Ospedale dell’Igea, Atene, Gracia
bDipartimento di Endocrinologia e Diabete, Ospedale dell’Igea, Atene, Grecia
cUniversità di Lione, CarMed Laboratorio, INSERM 1060, INRAE U1397, Lione, Francia
dUniversità Claude-Bernard di Lione, Lione Francia
INDICE CAPITOLO 3
Introduzione
La “epidemia metabolica” globale: substrato comune per un insieme di disordini
Omeostasi energetica e metabolismo del glucosio: il ruolo emergente degli inositoli
Gli inositoli sono coinvolti nella secrezione di insulina da parte delle cellule β del pancreas
I meccanismi molecolari e gli effetti metabolici: Dati sperimentali e animali
Il myo-inositolo (MI)
Il D-chiro-inositolo (DCI)
Il D-pinitolo (DPI)
Tradurre il contesto patogenetico in un possibile ruolo terapeutico degli inositoli nelle malattie metaboliche
L’industrializzazione, i progressi tecnologici e i loro concomitanti effetti ambientali, così come la rapida crescita della prosperità delle società “occidentalizzate”, hanno dato i natali alla piaga del 21° secolo, vale a dire, i disordini metabolici. Attraverso le sue due principali espressioni cliniche, l’obesità e il diabete mellito di tipo 2 (T2DM), il disordine metabolico è sempre più frequente, rappresentando una delle maggiori minacce per la salute, a causa delle sue conseguenze croniche e dei suoi effetti dannosi sulla qualità della vita e sulla longevità umana [1].
Per poter essere in grado di limitare il suo fiorente decorso, comprendere la fisiopatologia del disordine metabolico è stato riconosciuto come una priorità globale. Il metabolismo energetico dell’uomo è regolato da un’incessante interazione ormonale, che coordina l’apporto di cibo e il dispendio energetico, attraverso organi e tessuti metabolicamente attivi, come il fegato, il pancreas, il tessuto adiposo, il cervello, lo stomaco e la tiroide. La predisposizione genetica, i fattori ambientali che agiscono già durante la gestazione e gli stili di vita definiscono la “identità metabolica” di un individuo, attraverso i loro effetti sull’omeostasi energetica. Se da una parte la conoscenza delle basi del disordine metabolico continua ad aumentare, identificando nuovi targets fisiopatologici, le opzioni terapeutiche dovrebbero essere ampliate, offrendo una speranza per affrontare questa pandemia nel futuro.
In questo contesto, negli ultimi 20 anni l’inositolo è stato introdotto come un modulatore fisiologico del segnale dell’insulina e del metabolismo del glucosio. Inoltre, il rapporto tra i suoi metaboliti, myo- e D-chiro-inositolo, è cruciale per lo stato di salute di organi e tessuti, mentre uno squilibrio nei loro livelli o una loro deplezione nei tessuti periferici possono spiegare condizioni patologiche, inclusi i disordini metabolici. Pertanto, c’è un crescente interesse scientifico sulle possibili implicazioni terapeutiche degli inositoli nella gestione terapeutica dei disordini metabolici. Fino a oggi, i dati riportati in letteratura sono piuttosto incoraggianti, ma è necessario un numero maggiore di consolidate evidenze per stabilire la loro efficacia terapeutica in studi in larga scala [2].
Prevalenza e manifestazioni cliniche
Il disordine metabolico consiste in un’entità eterogenea sia a livello patogenetico che clinico, evidenziata come la più importante emergenza sanitaria pubblica negli ultimi 50 anni, dato che si accompagna a multimorbilità. L’obesità addominale, la dislipidemia, l’ipertensione, la steatosi epatica non alcolica (NAFLD), la sindrome metabolica, e il T2DM definiscono la “costellazione” dei disordini metabolici (Figura 1), e tutti questi sono strettamente correlati a un aumento del rischio di patologie croniche, come la patologia cardiovascolare (CVD), l’ipertensione, il cancro, le patologie neurologiche, e la sindrome dell’ovaio policistico (PCOS) [3].
L’obesità e il T2DM attualmente affliggono centinaia di milioni di individui di tutte le età a livello globale e si prevede un aumento durante la prossima decade. Nello specifico, più di 800 milioni di persone nel mondo sono obese, contemporaneamente ci si aspetta che nella prossima decade l’obesità infantile arrivi al 60%, raggiungendo quasi i 250 milioni di affetti entro il 2030 [4]. Allo stesso modo, si sta documentando un esponenziale aumento delle persone con diagnosi di diabete mellito (DM), che da 108 milioni nel 1980 è passato a 462 milioni nel 2017, corrispondenti al 6.28% della popolazione totale [5].
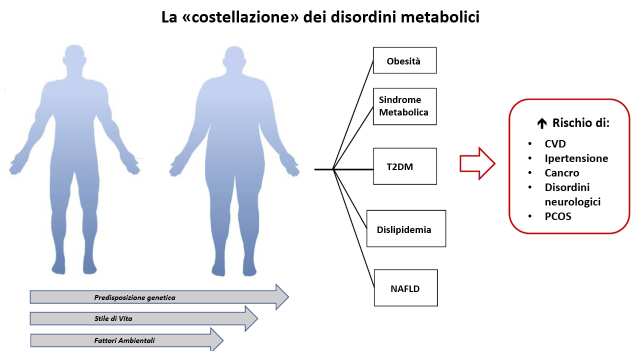
Figura 1: La “costellazione” dei disordini metabolici. La malattia metabolica è un’entità eterogenea sia a livello patogenetico che clinico, che comporta un insieme di condizioni cliniche, come l’obesità addominale, la dislipidemia, l’ipertensione, la steatosi epatica non alcolica (NAFLD), la sindrome metabolica, il diabete mellito di tipo 2 (T2DM), ciascuna delle quali predispone allo sviluppo di molteplici patologie croniche, incluse la patologia cardiovascolare (CVD), l’ipertensione, il cancro, i disordini neurologici, e la sindrome dell’ovaio policistico (PCOS).
Come anticipato, questi drammatici dati epidemiologici si associano a un aumento di morbidità e mortalità, a una ridotta qualità di vita e, inevitabilmente, e a un’escalation della spesa sanitaria mondiale. Se consideriamo l’indice di massa corporea (BMI), il rischio di multimorbilità cardiometabolica (es. T2DM, attacco coronarico e stroke) è il doppio nei pazienti sovrappeso e più di tre volte nelle persone gravemente obese, raffrontato agli individui con un BMI normale [6]. Tralasciando le morbilità, non ci sono dubbi che i disordini metabolici contribuiscono con importanza al dato di mortalità della popolazione. In un recente studio inglese e scozzese è stato evidenziato come l’eccesso di adipe a oggi conti un maggior numero di morti rispetto al fumo di sigaretta nelle persone di età media e avanzata [7]. Inoltre, nel 2019, il diabete è stata la nona causa di morte, stimando 1,5 milioni di morti causate da questa patologia [5].
La continua pandemia da COVID-19 ha fatto emergere lo scarso benessere metabolico della nostra società e il suo enorme onere per la salute pubblica. Ci sono forti evidenze che le persone con malattie metaboliche non solo sono più suscettibili a un’infezione più aggressiva da COVID-19 e a peggiori esiti, ma anche a un aumentato rischio di sequele acute post Covid-19.[8]. Ad esempio, in un recente studio, che ha coinvolto 46.441 pazienti ospedalizzati con il COVID-19, la sindrome metabolica è stata associata a un maggior rischio di ricovero presso le unità di terapie intensive (ICU) (adjusted odds ratio [aOR], 1,32), di ventilazione meccanica (aOR, 1,45), di sindrome acuta da distress respiratorio (ARDS) (aOR, 1,36), di mortalità (aOR, 1,19), e di una più lunga ospedalizzazione e permanenza nella ICU [9]. Riguardo l’ospedalizzazione, è stato stimato che approssimativamente il 20,5% delle ospedalizzazioni causa COVID-19 negli USA sono attribuibili al diabete mellito, il 30,2% all’obesità (BMI ≥30 kg/m2), il 26,2% all’ipertensione, e il 11,7% allo scompenso cardiaco, che insieme costituiscono più di 500.000 ospedalizzazioni da COVID-19 [10].
Non a caso, se proviamo a trasformare queste percentuali in dati finanziari, i numeri sono altrettanto preoccupanti. In accordo al CDC, il costo medico annuale stimato per l’obesità negli Stati Uniti nel 2008 è stato pari a 147 bilioni di dollari [11] e si presume superi 1 trilione di dollari nel 2025 [4]. Allo stesso modo, anche l’onere economico del T2DM è sbalorditivo. In uno studio condotto dall’Associazione Diabete Americana (ADA), è stato stimato che i costi totali legati alla diagnosi di diabete sono cresciuti da 245 bilioni di dollari nel 2012 a 327 bilioni nel 2017 (297$ nei costi medici diretti e 90$ bilioni nella riduzione della produttività), che rappresenta una crescita del 26% nell’arco dei cinque anni. Inoltre, è stato calcolato che le persone affette da T2DM hanno una spesa medica approssimativamente di 2,3 volte superiore, rispetto al resto della popolazione [12].
In conclusione, diventa sempre più chiaro come il benessere cardiometabolico sia cruciale per il benessere e la longevità dell’individuo. Combattere i disordini metabolici e le loro conseguenze avverse è l’enorme sfida per la tutela della salute pubblica, anche se gli attuali sforzi e strategie restano inadeguati per limitarne il decorso. Nell’era post-pandemica, la salute metabolica dovrebbe essere una priorità nel sistema sanitario globale, così da tenere sotto controllo in maniera efficace la crescente prevalenza della multimorbilità metabolica.
Nella sua forma libera, il myo-Ins si comporta come osmolita agendo nella citoprotezione; da un punto di vista evolutivo questa è anche la sua prima funzione fisiologica. In tal senso, i ruoli di questa molecola includono la compensazione osmotica, la stabilizzazione proteica e la prevenzione del congelamento, quando la componente acquosa dei tessuti raggiunge basse temperature [30]. Il D-chiro-inositolo (D-chiro-Ins), uno stereoisomero del myo-Ins, è un altro inositolo di grande interesse. La produzione endogena di questi due stereoisomeri varia a seconda delle specifiche necessità del tessuto [31]. Ad esempio, nelle donne sane, il loro rapporto nel plasma è 40:1 [32], mentre nel fluido follicolare ovarico è circa 100:1 [33]. In generale, esistono sette stereoisomeri del myo-Ins, che si formano naturalmente (scyllo-, muco, epi-, neo-, allo-, D- e L-chiro-inositolo), attraverso diversi enzimi isomerasi e un cis-inositolo, la cui esistenza in natura non è conosciuta [34].
Circa il 7% – 9% di myo-Ins viene trasformato in D-chiro-Ins come dimostrato dal composto 3H-radiomarcato; invece, gli altri stereoisomeri sono presenti in basse quantità, non più del 0.06% del totale del myo-Ins radiomarcato [35]. Alcuni distretti corporei, come il cervello, il cuore e le ovaie utilizzano grandi quantità di glucosio; per questa ragione loro mostrano un significativo contenuto di myo-Ins rispetto ad altri tessuti [36]. Per esempio, il cervello contiene livelli di myo-Ins da 10 a 15 volte più alti del sangue [37]. Il D-chiro-Ins è ottenuto dal myo-Ins attraverso una reazione unidirezionale. L’enzima chiave che catalizza questa reazione è l’epimerasi, un enzima tessuto-specifico e nicotinamide adenina dinucletotide (NAD)-NADH- dipendente, che lavora sotto lo stimolo dell’insulina [38]. In questo modo, ogni organo e tessuto sfrutta il rapporto specifico e appropriato che c’è tra il contenuto di myo-Ins e D-chiro-Ins, necessario per mantenere le condizioni fisiologiche [39].
Gli inositoli sono fisiologicamente coinvolti nella segnalazione dell’insulina
I principali ruoli dell’insulina sono promuovere l’uptake intracellulare del glucosio (principalmente a livello delle cellule adipose e muscolari) ed inibire la produzione epatica di glucosio (derivante dall’idrolisi del glicogeno e/o dalla gluconeogenesi) per ridurre il livello di glucosio plasmatico. Nelle cellule bersaglio, l’insulina si lega ad un recettore tirosinchinasico e ne provoca l’autofosforilazione su residui tirosina situati nel dominio citoplasmatico [23]. Queste fosfo-tirosine sono riconosciute dagli adattatori molecolari IRS-1/2, che interagiscono anche con l’enzima fosfatidilinositolo 3-chinasi (PI3K). IRS-1/2 interagisce con la subunità regolatoria p85 di PI3K, il cui ruolo è regolare l’attività della subunità catalitica p110. IRS1/2 attivati promuovono la fosforilazione di p85, riducendo la sua inibizione sulla subunità p110 e aumentando l’attività enzimatica della PI3K. La PI3K favorisce la fosforilazione del fosfatidilinositolo-4,5-bisfosfato (PIP2) in fosfatidilinositolo-3,4,5-trifosfato (PIP3), che attiva le chinasi dipendenti dall’inositide-3-fosfato 1/2 (PDK1/2) che, a sua volta, promuove la fosforilazione di serina/treonina della proteina chinasi B/Akt (PKB/Akt). Nel tessuto muscolare e adiposo, PKB/Akt attivato stimolerà la traslocazione dei trasportatori del glucosio GLUT4 alla membrana plasmatica per consentire al glucosio di entrare nelle cellule [23]. Nel fegato, PKB/Akt attiverà la fosforilazione della glicogeno sintasi chinasi 3 (GSK3) per migliorare la sintesi del glicogeno, mentre inibirà il fattore di trascrizione FOXO1 che promuove la gluconeogenesi [23].
In determinate condizioni, il controllo del trasporto del glucosio da parte dell’insulina sembra non essere connesso al suo effetto sulla sintesi del glicogeno [24,25], suggerendo che la segnalazione dell’insulina potrebbe procedere lungo diverse vie per il trasporto del glucosio e il suo metabolismo [26]. Larner e colleghi hanno suggerito che, oltre agli eventi di fosforilazione avviati dall’attivazione del recettore tirosinchinasico, potrebbero essere generati anche alcuni secondi messaggeri intracellulari dell’insulina [27]. Questi presunti secondi messaggeri dell’insulina sono stati storicamente estratti da tessuti sensibili all’insulina (ad esempio, fegato o muscoli) stimolati con insulina e hanno mostrato attività insulino-mimetica in vitro e in vivo [27]. Il myo-inositolo (MI) e il D-chiro inositolo (DCI) sono i principali componenti di questi secondi messaggeri rilasciati durante l’attivazione della via di segnalazione dell’insulina.
Questi secondi messaggeri generati in risposta all’insulina vengono chiamati “inositolo fosfoglicani” (IPG) [28]. L’analisi strutturale degli IPG insulino-mimetici isolati dai tessuti bersaglio dell’insulina nei mammiferi ha rivelato due tipi diversi di IPG [29]. Gli IPG di tipo A sono composti da MI e D-glucosammina, mentre gli IPG di tipo P sono composti da D-galattosammina e 3-O-metil-DCI (ovvero la forma metilata in posizione 3 del DCI). Queste due classi di IPG mostrano ulteriori attività biologiche diverse. Mentre gli IPG-A imitano l’attività lipogenica dell’insulina nel tessuto adiposo e inibiscono la proteina chinasi dipendente da cAMP (PKA) [29], gli IPG-P imitano l’effetto glicogenico dell’insulina nel muscolo e nel fegato attraverso la stimolazione della piruvato deidrogenasi fosfatasi (PDHP) [29-31].
Gli IPG di tipo A sono correlati ai glicolipidi del glicosilfosfatidilinositolo (GPI), un componente principale degli ancoraggi GPI presenti sulla superficie di tutte le cellule dei mammiferi. L’origine degli IPG di tipo P nelle cellule dei mammiferi, tuttavia, rimane poco chiara. Si ritiene che l’insulina stimoli la scissione degli ancoraggi GPI da parte di alcune fosfolipasi C (PLC) e/o fosfolipasi D (PLD) con la produzione di IPG liberi all’esterno delle cellule [32]. Gli IPG vengono quindi trasportati all’interno delle cellule attraverso un trasportatore a processo energetico sconosciuto [33]. Gli IPG attivano la fosfoproteina fosfatasi 2Cα (PP2Cα) citosolica [34]. PP2C defosforila e attiva sia la glicogeno sintasi (GS) che la PI3K [35]. La PP2Cα attivata stimola ulteriormente la GS sia attraverso meccanismi diretti che indiretti, tramite la via PI3K/Akt. Gli IPG stimolano l’attività della piruvato deidrogenasi (PDH) attraverso l’attivazione della fosfatasi della piruvato deidrogenasi (PDHP) [36,37] e quindi potenziano il metabolismo ossidativo del glucosio attraverso il ciclo dell’acido tricarbossilico [27] (Figura 2). Le specifiche attività biologiche di diversi IPG insulino-mimetici sono state esaminate e raccolte da Goel et al. [38]. Per ottenere una migliore comprensione della relazione struttura-attività degli IPG, Hecht et al. [39] hanno sintetizzato chimicamente un gruppo di IPG che sono stati ampiamente testati sia in vitro che in vivo (fosforilazione di PKB/Akt, captazione del glucosio, test di lipogenesi, attività ipoglicemica). Contrariamente a quanto riportato in precedenza, nessuno degli IPG sintetici testati era insulino-mimetico, mettendo in discussione il loro effettivo farmacoforo e/o la loro attività biologica.
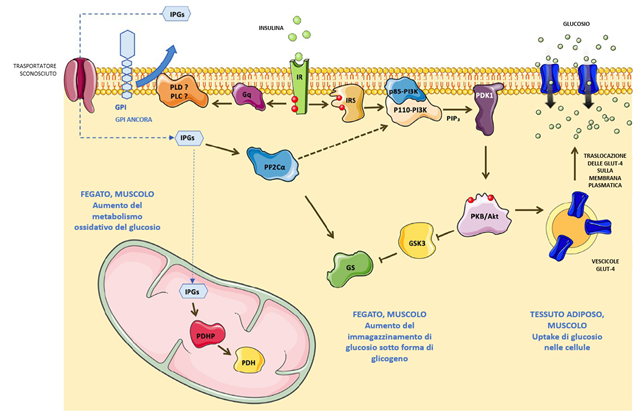
Figura 2 Inositolo fosfoglicani (IPG) come secondi messaggeri dell’insulina. Nella via canonica di segnalazione, quando l’insulina lega il suo recettore (IR), il recettore si autofosforila, recluta e attiva la proteina adattatrice IRS-1. L’IRS-1 attivato attiva la PI3K per generare PIP3, che a sua volta attiva PDK1 e successivamente PKB/Akt. PKB/Akt attivato induce la traslocazione dei trasportatori del glucosio GLUT-4 sulla membrana plasmatica per permettere al glucosio extracellulare di entrare nelle cellule (muscolari e adipose). Nelle cellule muscolari e epatiche, PKB/Akt inibisce GSK3 per promuovere la sintesi del glicogeno. Secondo la teoria di Larner e Brautigan, l’attivazione del recettore dell’insulina potrebbe anche essere accoppiata a una proteina G eterotrimerica che potrebbe attivare una fosfolipasi C o D responsabile dell’idrolisi di GPI con il rilascio di inositolo-fosfoglicani solubili (IPG) all’esterno della cellula. Attraverso un trasportatore sconosciuto, gli IPG vengono importati all’interno delle cellule dove agiscono come secondi messaggeri dell’insulina. Nel citoplasma, gli IPG attivano PP2Cα che contribuisce all’attivazione della glicogeno sintasi (GS). Nei mitocondri, gli IPG attivano PDHP per potenziare l’attività di PDH e promuovere il metabolismo ossidativo del glucosio. Si noti che tutti i pathway molecolari presentati in questa figura possono verificarsi in diversi tipi di cellule (ad esempio, captazione del glucosio nelle cellule adipose e muscolari, sintesi del glicogeno nelle cellule epatiche e muscolari). GLUT-4, trasportatore del glucosio 4; GPI, glicosilfosfatidilinositolo; GS, glicogeno sintasi; GSK3, glicogeno sintasi chinasi 3; IR, recettore dell’insulina; IPG, inositolo-fosfoglicano; IRS1, substrato del recettore dell’insulina 1; PDH, piruvato deidrogenasi; PDHP, fosfatasi piruvato deidrogenasi; PDK-1, chinasi dipendente da 3-fosfoinositide 1; PI3K, fosfoinositide-3-chinasi; PIP3, fosfatidilinositolo 4,5 bisfosfato; PKB/Akt, proteina chinasi B/Akt; PP2Cα, fosfatasi fosfoproteina 2C alfa. Adattato da Croze, M. L., Soulage, C. O. (2013). Potential role and therapeutic interests of myo-inositol in metabolic diseases. Biochimie, 95(10), 1811–1827.Biochimie, 95(10), 1811–1827. https
Una categoria successiva di inositoli coinvolti nella segnalazione dell’insulina è rappresentata dalla famiglia degli inositolo-fosfati . Gli inositolo-fosfati sono un gruppo diversificato di molecole di segnalazione in cui gruppi idrossilici posizionati attorno ad un anello di inositolo sono fosforilati in diverse combinazioni da specifiche chinasi. Questi includono l’inositolo trifosfato (IP3), l’inositolo pentafosfato (IP5), l’inositolo esafosfato (IP6), noto anche come acido fitico, e l’inositolo pirofosfato (IP7). L’IP7, prodotto in risposta all’insulina, è stato dimostrato inibire PKB/Akt [40], contribuendo così a un meccanismo di feedback che regola la segnalazione dell’insulina.
Oltre al loro effetto sulla segnalazione dell’insulina, gli inositolo-fosfoglicani contenenti DCI (DCI-IPG) stimolano la secrezione di insulina dalle cellule β pancreatiche [41] attraverso la chiusura dei canali del potassio sensibili all’ATP. Infatti, l’effetto dei DCI-IPG sulla secrezione di insulina viene impedito dal blocco farmacologico dei canali del potassio sensibili all’ATP mediante la tolbutamide. L’effetto dei DCI-IPG sui canali del potassio sensibili all’ATP è anche mediato dalla proteina fosfatasi 2C (PP2C), poiché il silenziamento genetico del gene PP2C previene questo effetto [41]. Inoltre, è stato dimostrato che l’IP7 favorisce la secrezione di insulina da parte delle cellule β pancreatiche [42].
Ci sono sempre più prove sperimentali che gli inositoli o i derivati dell’inositolo potrebbero migliorare il metabolismo del glucosio e il controllo glicemico (come riassunto in Ref. [43]). La maggior parte degli studi sperimentali si è concentrata su un alcuni di composti, principalmente MI, DCI e D-pinitolo (DPI).
L’azione ipoglicemica del MI, assunto con la dieta, è stata inizialmente riportata da Ortmeyer et al. nella scimmia Rhesus con diabete di tipo 2 [44,45]. Il MI (0,9 e 1,2 g/kg di peso corporeo) migliora la tolleranza al glucosio nei topi principalmente attraverso un effetto di sensibilizzazione all’insulina [46] e aumenta la traslocazione di GLUT4 sulla membrana plasmatica [47]. Il MI sembra essere efficace anche in diversi modelli animali di diabete, anche se esistono alcuni dati contrastanti. Il MI (1% nella dieta, oltre ad alcune vitamine) migliora la sensibilità all’insulina nelle topoline incinte db/+ utilizzate come modello di diabete gestazionale [48]. Il MI (1 g/kg di peso corporeo) riduce l’assorbimento intestinale del glucosio e aumenta il prelievo di glucosio nel muscolo sia nei ratti normali sia nei ratti diabetici di tipo 2 [49]. Il MI (25-50 mg/kg di peso corporeo) migliora il controllo glicemico e la dislipidemia nei ratti con diabete di tipo 2 [50]. Nelle cellule endoteliali umane, il MI (fino a 1 mmol/L) ha un effetto insulino-mimetico e stimola la via di segnalazione dell’insulina, come dimostrato dalla fosforilazione di PKB/Akt [51].
La supplementazione orale di MI (50 mg/kg di peso corporeo) riduce l’insulino-resistenza (attraverso la soppressione del segnale fosfo-STAT3 e IL6) in un modello murino affetto da sindrome dell’ovaio policistico (PCOS) [52]. La supplementazione di MI (da 0,4 a 10 mg al giorno) durante l’allattamento migliora la salute metabolica e l’insulino-resistenza nei ratti maschi esposti a una nutrizione fetale inadeguata e a una dieta diabetogena in età adulta, mentre sorprendentemente non si è osservato alcun effetto nelle femmine [53]. Al contrario di questi dati, il MI (1% nella dieta) non è riuscito a migliorare il controllo glicemico nei ratti diabetici di tipo 1 [54] o somministrato a dosi di 0,58 g/kg di peso corporeo non è riuscito a migliorare l’insulino-resistenza nei topi alimentati con una dieta ad alto contenuto di grassi [55]. Tuttavia, questa ultima dose potrebbe essere troppo bassa per produrre effetti significativi.
Mostra attività insulino-mimetica e insulino-sensibilizzante ancora più potenti rispetto al MI [27,56–58]. Nelle cellule endoteliali umane, il DCI (fino a 1 mmol/L) è insulino-mimetico e stimola la fosforilazione di PKB/Akt [51]. L’infusione di DCI-fosfoglicano normalizza la glicemia plasmatica nei ratti diabetici di tipo 1 [59], mentre il DCI (15 mg/kg di peso corporeo) da solo diminuisce la glicemia plasmatica nei ratti diabetici di tipo 2 [60]. Il DCI (30-60 mg/kg di peso corporeo) migliora l’assorbimento del glucosio mediato dall’insulina nei ratti con diabete di tipo 2 [61]. L’assunzione, attraverso la dieta, di DCI in topi obesi diabetici KK-A(y) riduce la glicemia plasmatica, migliora la tolleranza al glucosio e aumenta il contenuto di insulina nel pancreas [62].
In un’analisi transcrittomica su epatociti primari incubati con palmitato per indurre insulino-resistenza, il DCI (10 μmol/L) ha modificato il profilo dell’espressione di geni specificamente correlati all’insulino-resistenza e al metabolismo del glucosio [63]. Il DCI (35 e 70 mg/kg di peso corporeo, per os) migliora significativamente il metabolismo del glucosio e previene la glucotossicità (ad esempio, la produzione di prodotti finali di glicazione avanzata) nei topi diabetici db/db [64]. Il DCI migliora la sensibilità all’insulina attraverso l’inibizione della gluconeogenesi epatica e la riduzione della produzione epatica di glucosio (tramite la stimolazione della via di segnalazione PKC-ε-IRS/PI3K/Akt) nei topi alimentati con una dieta ricca di grassi [65].
Il DPI, o 3-O-metil-chiro-inositolo, è un derivato metilato di DCI comunemente presente nelle piante e nelle verdure (ovvero una fonte dietetica significativa di DCI). Somministrato ai topi, il DPI (2 g/kg ip) stimola la translocazione di GLUT4 sulla membrana plasmatica a livello del muscolo scheletrico [47]. Il DPI (5 mg/kg di peso corporeo) riduce la glicemia plasmatica nei ratti affetti da diabete di tipo 2 indotto da streptozotocina a basso dosaggio [60]. Il DPI attiva la via di segnalazione dell’insulina (via PI3K/Akt) nell’ipotalamo e potrebbe quindi essere utile per prevenire disturbi cerebrali associati all’insulino-resistenza [66]. Nei topi obesi, il DPI potenzia la secrezione insulinica indotta dal glucosio, ma promuove la lipogenesi epatica e l’accumulo di trigliceridi nel fegato [67]. Nei ratti, il DPI somministrato per via orale riduce la secrezione insulinica attraverso l’aumento dell’espressione della ghrelina (un noto inibitore della secrezione insulinica) e inibisce la produzione epatica di glucosio [68].
Obesità
Nonostante i significativi progressi compiuti nella comprensione della patogenesi multifattoriale dell’obesità, gli avanzamenti terapeutici odierni non hanno rappresentato un balzo in avanti nella gestione clinica della malattia. Proprio come la sua eziologia, la gestione dell’obesità è caratterizzata da una serie di pilastri terapeutici, tra cui la dieta, l’esercizio fisico, il trattamento farmacologico e la chirurgia, che mirano a diversi punti critici fisiopatologici al fine di generare un bilancio negativo tra consumo ed esposizione energetica. Inoltre, la marcata variabilità nella risposta degli individui a qualsiasi forma di trattamento è una delle caratteristiche uniche e irrisolte dell’obesità che rende necessaria una gestione personalizzata e una terapia combinata [69].
A causa di tutti i ruoli fisiologici precedentemente menzionati nel metabolismo energetico e nella segnalazione dell’insulina, l’integrazione di inositolo ha attratto l’interesse scientifico per i presunti effetti sulla gestione del peso e sulla funzione insulinica [70]. I dati primari provengono da modelli animali, in cui i topi knockout per l’inositolo esafosfato chinasi (IP6K) mostravano un peso corporeo ridotto, con una riduzione della percentuale di massa grassa e un aumento concomitante della percentuale di massa magra. Inoltre, quando sono stati sottoposti a una dieta ad alto contenuto di grassi, i topi knockout per IP6K sono risultati resistenti all’obesità e caratterizzati da un profilo metabolico migliore, compresa una diminuzione della glicemia, del colesterolo totale, dei trigliceridi, della funzione epatica e della leptina, attribuita alla riduzione del percorso Akt [40, 71, 72]. Akt è una chinasi serina/treonina che regola l’omeostasi del glucosio e la traduzione delle proteine, rispettivamente, attraverso i percorsi GSK3β e mTOR, che erano espressi in modo anomalo nel muscolo scheletrico, nel tessuto adiposo bianco e nel fegato dei topi con una delezione mirata di IP6K1, limitando la resistenza insulinica e l’adipogenesi e fungendo da potenziale bersaglio terapeutico per l’obesità e il diabete [40] (vedi Fig. 3).
La ristrutturazione del tessuto adiposo bianco (WAT) e la regolazione dell’energia sono cruciali per la patogenesi dell’obesità. Il WAT risponde all’eccesso calorico attraverso un’espansione salutare o non salutare. L’espansione salutare, tramite iperplasia degli adipociti, protegge dalle complicanze metaboliche dell’obesità. D’altra parte, l’espansione non salutare, tramite ipertrofia degli adipociti, è accompagnata da alterazioni dannose del metabolismo cellulare, tra cui un aumento della lipolisi e della fuoriuscita di acidi grassi liberi (FFA), un’alterata segnalazione dell’insulina in parte dovuta alla lipotossicità, un aumento dell’infiammazione, una secrezione alterata di adipochine e un accumulo di grasso ectopico [73]. Pertanto, comprendere la fisiologia del tessuto adiposo e il suo contributo nell’omeostasi energetica sistemica, nonché il suo mirato trattamento terapeutico, è essenziale per affrontare l’obesità e le sue comorbilità metaboliche. In questo contesto, il ruolo dell’inositolo nel metabolismo del tessuto adiposo è stato recentemente valutato in uno studio sperimentale che ha utilizzato una linea cellulare di adipociti umani. In tale studio, gli autori hanno scoperto che il DCI è attivamente coinvolto nella fisiologica differenziazione e funzionalità degli adipociti umani, dove agisce in sinergia con l’insulina e gli estrogeni attraverso il reclutamento di vie di trasduzione del segnale coinvolte nello stoccaggio dei lipidi e del glucosio, aumentando l’espressione e l’attivazione di IRS1 e GLUT4 [74]. Allo stesso modo, l’eliminazione di IP6K1 nelle cellule adipose di un modello murino aumenta la spesa energetica e l’ossidazione dei lipidi tramite la proteina chinasi attivata dall’AMP (AMPK) e diminuisce la sintesi degli acidi grassi negli adipociti 3T3-L1 [75].
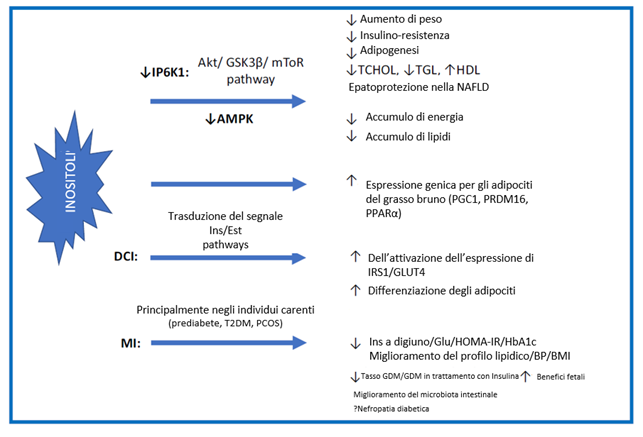
Figura. 3 Riepilogo delle azioni degli inositoli nei disturbi metabolici. Gli inositoli sembrano essere promettenti nel mirare alla maggior parte degli aspetti dei disturbi metabolici. Sono mostrati anche i possibili meccanismi. Inositolo esafosfato chinasi 1 (IP6K1), proteina chinasi attivata da AMP (AMPK), colesterolo totale (TCHOL), trigliceridi (TGL), lipoproteine ad alta densità (HDL), malattia del fegato grasso non alcolica (NAFLD), proteina disaccoppiante 1 (UCP1), coattivatore 1-alfa del recettore gamma attivato dal proliferatore di perossisomi (PGC1), dominio PR contenente il gene 16 (PRDM16), recettore alfa attivato dal proliferatore di perossisomi (PPARα), insulina (Ins), estrogeno (Est), substrato del recettore dell’insulina 1 (IRS1), trasportatore del glucosio di tipo 4 (GLUT4), diabete mellito di tipo 2 (T2DM), sindrome dell’ovaio policistico (PCOS), glucosio (Glu), Valutazione del modello di omeostasi dell’insulino-resistenza (HOMA-IR), emoglobina glicata (HbA1c), indice di massa corporea (BMI), diabete mellito gestazionale (GDM), trattamento (Tx).
Un altro attore recentemente scoperto nella patogenesi dell’obesità è il microbiota intestinale, la comunità collettiva di microrganismi presenti nel tratto gastrointestinale. Oltre al loro ruolo gastrointestinale, la composizione del microbiota intestinale è cruciale nel modificare i processi metabolici attraverso vari meccanismi. Ad esempio, un’elevata presenza di batteri che fermentano i carboidrati porta ad un aumento della velocità di sintesi degli acidi grassi a catena corta (SCFA), fornendo una fonte extra di energia per l’ospite, che viene poi immagazzinata come lipidi o glucosio. Inoltre, il microbiota può aggravare l’infiammazione di basso grado e, di conseguenza, la resistenza all’insulina, aumentando la permeabilità intestinale ai lipopolisaccaridi batterici (LPS) [77,78]. Sebbene i dati siano ancora estremamente limitati, sembra che l’assunzione di MI (myo-inositolo) possa avere un ruolo metabolico in sinergia con il microbiota intestinale. In uno studio condotto su ratti alimentati con una dieta ad alto contenuto di saccarosio, l’assunzione di MI ha normalizzato la concentrazione epatica di trigliceridi e soppresso l’espressione epatica dei geni lipogenici, mediante un miglioramento concomitante della composizione del microbiota [79,80].
Nonostante i dati sperimentali finora siano promettenti, attualmente la letteratura scientifica manca di dati clinici robusti per supportare il ruolo dell’inositolo nell’obesità. Per quanto ne sappiamo, gli unici studi umani sugli effetti dell’inositolo sul peso provengono principalmente da donne con sindrome dell’ovaio policistico (PCOS) [81]. Allo stesso tempo, ci sono alcuni rapporti clinici preliminari che forniscono prove convincenti a sostegno degli effetti benefici ottenuti con l’inositolo nei pazienti insulino-resistenti, che potrebbero essere associati a risultati clinici positivi. Tuttavia, è estremamente importante procedere con studi clinici randomizzati ben organizzati che ci consentano di stabilire chiaramente il ruolo sfidante dell’inositolo nella gestione dell’obesità.
Insulino-resistenza e diabete mellito di tipo 2
Come chiaramente indicato in precedenza, l’inositolo, attraverso i suoi isomeri (MI e DCI) e probabilmente alcuni dei suoi metaboliti intermedi fosfati e gli enzimi correlati (come IP6K1), è attivamente coinvolto nella segnalazione dell’insulina e nel metabolismo del glucosio, influenzando distinti percorsi [82]. Dati sperimentali e clinici mettono in evidenza che il deterioramento dei processi fisiologici legati all’assorbimento di MI, alla biosintesi de novo, alla rigenerazione del ciclo del fosfoinositide, all’efflusso e alla degradazione, che possono portare a una deplezione di MI nei tessuti insulino-sensibili, può predisporre gli individui alla resistenza insulinica e al diabete di tipo 2 (T2DM). Allo stesso tempo, si osserva anche una diminuzione dell’attività dell’epimerasi e una riduzione dell’assorbimento di MI a livello renale nei soggetti diabetici o nei fratelli di famiglie con predisposizione al T2DM, indicando ulteriormente il coinvolgimento dell’inositolo nell’eziologia multifattoriale delle malattie metaboliche [79,82].
Attualmente, i dati più solidi riguardanti le proprietà insulino-mimetiche dell’inositolo provengono da donne con sindrome dell’ovaio policistico (PCOS) [83]. A differenza di altri tessuti nel diabete di tipo 2 e nella PCOS che mostrano un’aumentata resistenza all’insulina, come il fegato e il muscolo, l’ovaio rimane sensibile all’insulina. Di conseguenza, l’iperinsulinemia successiva può portare a un’eccessiva epimerizzazione di MI in DCI, tramite l’enzima epimerasi NAD/NADPH dipendente dall’insulina nel tessuto ovarico, supportando l’ipotesi del “paradosso ovarico” [83]. L’aumentata disponibilità di DCI rispetto alla deplezione di MI e l’aggravarsi delle caratteristiche della PCOS quando veniva somministrato solo DCI, hanno portato al suggerimento che entrambe le isoforme dovrebbero essere somministrate al fine di ripristinare lo squilibrio alterato di MI/DCI. Dopo prove con varie combinazioni di MI/DCI somministrate a un modello murino con PCOS di fenotipo iperandrogenico, il trattamento giornaliero con 420 mg/kg di MI/DCI in un rapporto di 40:1 sembrava essere il più efficace nel riportare alla normalità il fenotipo della PCOS [84].
Oltre ai loro effetti sulla riproduzione, le isoforme dell’inositolo si sono dimostrate efficaci nel migliorare la resistenza all’insulina, con una significativa riduzione dei livelli di glucosio, C-peptide e dell’indice HOMA-IR; diminuendo la pressione sanguigna e migliorando il profilo lipidico. Riducendo la resistenza all’insulina, l’inositolo può in definitiva migliorare l’iperandrogenismo, regolarizzare il ciclo mestruale e aumentare i tassi di fertilità [85].
In questo contesto, una serie di studi sperimentali e interventistici condotti sia su esseri umani che su animali ha cercato di chiarire se questo ruolo dell’inositolo nell’aumentare la sensibilità all’insulina possa essere osservato nelle malattie metaboliche e nel diabete di tipo 2 (T2DM). Più specificamente, l’integrazione di MI nei ratti ha inibito l’assorbimento intestinale del glucosio e aumentato l’assorbimento muscolare del glucosio [49], mentre un DCI-fosfoglicano isolato originariamente dal fegato bovino ha agito come insulino-mimentico e insulino-sensibilizzante, riducendo il peso corporeo e l’assunzione di cibo quando somministrato per via intracerebroventricolare ai topi [86]. Allo stesso modo, gli studi sull’uomo supportano l’idea che l’integrazione di MI, con o senza l’integrazione di DCI, a dosi comprese tra 2 e 10 g al giorno, possa migliorare la sensibilità all’insulina, il profilo lipidico e la pressione arteriosa nei pazienti con prediabete o sindrome metabolica. In uno studio recente su pazienti con T2DM con controllo glicemico subottimale (HbA1c 7,0% – 10,0%) già in terapia con farmaci ipoglicemizzanti, l’integrazione di MI e DCI nel loro regime terapeutico abituale per 3 mesi ha portato a una significativa riduzione sia della glicemia a digiuno (192,6 ± 60,2 versus 160,9 ± 36,4; p = 0,02) che dell’HbA1c (8,6% ± 0,9% versus 7,7% ± 0,9%; p = 0,02) rispetto al basale, senza modifiche della pressione arteriosa, del profilo lipidico e dell’IMC [87]. Conclusioni analoghe sono state raggiunte dagli autori di una recente meta-analisi e revisione sistematica, che ha valutato un totale di 20 RCT con 1239 soggetti. L’assunzione di MI a dosi comprese tra 600 e 4000 mg è stata associata a una riduzione della glicemia a digiuno, della glicemia post-OGTT, dell’insulina a digiuno e dell’HOMA-IR, indipendentemente dai cambiamenti nel peso corporeo [88]. Infine, a causa dell’osservazione che vi è un’aumentata escrezione di MI nelle urine nei pazienti con resistenza insulinica e T2DM, si sta valutando una potenziale ulteriore applicazione di MI nella nefropatia diabetica, ma ancora mancano studi clinici adeguati [82,89].
Non sorprendentemente, l’efficacia dell’inositolo è stata estesa anche nella prevenzione e nel trattamento del diabete gestazionale (GDM). Diversi studi clinici hanno dimostrato la sua efficacia nel ridurre i tassi di GDM, migliorare la glicemia gestazionale, i parametri di resistenza lipidica e insulinica, nonché nel ridurre la necessità di terapia insulinica nel caso in cui si sviluppi successivamente il GDM [2]. Inoltre, uno studio recente condotto da D’Anna et al. ha evidenziato come l’integrazione di inositolo e α-lattalbumina ha avuto anche effetti benefici per il feto, riducendo la circonferenza addominale fetale e lo spessore del tessuto adiposo sottocutaneo neonatale, senza casi di parto prematuro.
In generale, non vi è dubbio che l’inositolo abbia un ruolo fisiologico e fisiopatologico nella segnalazione dell’insulina e nel metabolismo del glucosio. Ciò che resta da fare ora è tradurre queste osservazioni in benefici clinici concreti. Nonostante ci siano alcuni rapporti clinici preliminari, è necessaria una maggiore evidenza convincente per introdurre l’inositolo nel nostro “arsenale terapeutico” contro le malattie metaboliche.
Altri aspetti della sindrome metabolica
La dislipidemia costituisce una parte integrante della sindrome metabolica (MetS) e contribuisce in egual misura allo sviluppo delle malattie cardiovascolari (CVD). Con l’insulino-resistenza che funge da orchestratore, la dislipidemia della MetS è caratterizzata dalla cosiddetta triade lipidica: alti livelli di trigliceridi plasmatici, bassi livelli di colesterolo ad alta densità (HDL) e la comparsa di lipoproteine a bassa densità (LDL) piccole e dense, nonché da una lipemia postprandiale eccessiva, tutto ciò originato dalla sovraproduzione epatica di lipoproteine a bassa densità molto ricche di trigliceridi (VLDL) [91]. In uno studio recente su un ampio campione di adulti sovrappeso/obesi con diabete di tipo 2 (T2DM), si è osservato che la presenza delle suddette alterazioni lipidiche era associata a un rischio più elevato di eventi aterosclerotici cardiovascolari, evidenziando che affrontare la dislipidemia è cruciale per limitare gli effetti avversi dell’aterosclerosi [92].
In questo contesto, una moltitudine di studi è stata condotta per determinare se l’integrazione di inositolo avesse qualche effetto sul profilo lipidico, principalmente in individui con sindrome metabolica (MetS) o sindrome dell’ovaio policistico (PCOS) [79]. In uno studio su 80 donne in postmenopausa affette da sindrome metabolica, l’integrazione di MI ha portato a una riduzione dei trigliceridi e un aumento dei livelli di HDL, insieme a una diminuzione della pressione arteriosa diastolica e dell’indice HOMA [93]. Allo stesso modo, in uno studio condotto in Corea su 30 pazienti con diabete di tipo 2 (T2DM), la somministrazione di pinitolo derivato dalla soia (D-3-O-metil-chiro-inositolo) ha portato a un calo del colesterolo totale, delle LDL e del rapporto LDL/HDL, e a un innalzamento dell’HDL, ma non ha influenzato i livelli di trigliceridi [94]. Infine, in una meta-analisi di un totale di 14 studi controllati randomizzati condotti su popolazioni con malattie metaboliche, è stato evidenziato che l’integrazione di inositolo comporta un miglioramento dei trigliceridi, dei livelli di colesterolo totale e delle LDL, ma non sembra avere effetti apparenti sui livelli di colesterolo HDL [95].
Non sorprendentemente, sono stati osservati effetti benefici anche nella popolazione con PCOS [96]. Constantino et al. hanno studiato gli effetti dell’integrazione di MI più acido folico in 42 donne con PCOS e hanno mostrato una significativa diminuzione dei trigliceridi plasmatici, rispetto al placebo, in parallelo con un miglioramento della sensibilità all’insulina [97]. Più recentemente, Shokrpour et al. hanno confrontato gli effetti della somministrazione di MI e metformina per 12 settimane sul controllo glicemico, profilo lipidico e l’espressione genica correlata al metabolismo dell’insulina e dei lipidi nelle donne con PCOS, e hanno mostrato effetti benefici sui livelli di trigliceridi e colesterolo VLDL, senza però modifiche dell’espressione di LDL, HDL o del recettore delle LDL [98].
Complessivamente, è evidente che gli inositoli possono influire in modo positivo sulle anomalie lipidiche, attraverso vari meccanismi, tra cui il miglioramento della resistenza all’insulina o la riduzione dell’accumulo di grasso viscerale ed epatico. Sono necessari studi clinici randomizzati su larga scala per convalidare tutti i dati sopra menzionati e definire gli inositoli come elementi fondamentali nella gestione terapeutica della dislipidemia. In parallelo all’aumento delle prevalenze di obesità e MetS, la prevalenza della NAFLD è aumentata drasticamente fino a oltre il 25% della popolazione mondiale, che sale oltre il 60% nelle popolazioni ad alto rischio, come i pazienti con T2DM. La NAFLD è definita dall’accumulo di grasso intracellulare in >5% degli epatociti all’imaging o all’esame istologico, in assenza di altre cause di steatosi epatica come l’eccessivo consumo di alcol, determinate condizioni metaboliche o uso di farmaci, ed è considerata la componente epatica della MetS, contribuendo anche alle comorbilità, tra cui T2DM e CVD, e determinando un notevole onere per la sanità. La patogenesi della NAFLD è complessa. Tuttavia, la resistenza all’insulina e il disfunzionamento del tessuto adiposo sono centrali, causando un aumento del flusso di FFA circolanti verso il fegato e alterando il metabolismo epatico, con aumento della gluconeogenesi epatica, resistenza insulinica epatica e iperglicemia [99].
Date le sue funzioni in altri disordini metabolici, risulta piuttosto difficile capire se l’inositolo abbia anche un effetto benefico nella NAFLD (steatosi epatica non alcolica). Nel complesso, i dati attuali della letteratura sono limitati, con la maggior parte di essi provenienti da studi su animali. Tuttavia, è stato osservato che la carenza di inositolo è associata a un aumento del grasso nel fegato, mentre contemporaneamente l’integrazione di inositolo in modelli animali di fegato grasso ha portato alla riduzione degli accumuli di trigliceridi e colesterolo epatici e al mantenimento di una normale istopatologia epatica a livello ultrastrutturale [100]. Allo stesso modo, nell’unico studio umano presente nella letteratura, in cui 90 soggetti con NAFLD confermata tramite ecografia sono stati randomizzati in modo casuale al gruppo placebo, al gruppo con bassa dose (300 mg/giorno) o al gruppo con alta dose (500 mg/giorno) di pinitolo per 12 settimane, si è constatato che il pinitolo ha ridotto significativamente il grasso epatico, i trigliceridi postprandiali, i livelli di AST e la perossidazione lipidica mediante l’aumento dell’attività della glutatione perossidasi. Tutti questi effetti modulatori sulle vie energetiche e metaboliche, insieme al miglioramento dello stress ossidativo e all’accumulo di acidi grassi, possono conferire benefici epatoprotettivi nei soggetti con NAFLD [101].
L’inositolo e le sue due principali isoforme sono considerati componenti fisiologici e secondi messaggeri di vari processi biologici, tra cui la segnalazione dell’insulina e l’omeostasi del glucosio. Qualsiasi carenza di tessuto o potenziale perturbazione della fisiologia dell’inositolo può tradursi in una compromissione della segnalazione dell’insulina negli organi metabolicamente attivi, nello sviluppo di resistenza all’insulina e, in ultima analisi, nella manifestazione di malattie metaboliche.
Di conseguenza, l’inositolo è riconosciuto come uno dei possibili trattamenti adiuvanti per contrastare l’epidemia contemporanea di obesità e diabete di tipo 2. Indubbiamente, c’è bisogno di studi più ben organizzati e su larga scala per convalidare le nostre osservazioni sperimentali e cliniche e approfondire ulteriormente il ruolo dell’inositolo nel metabolismo umano. Tuttavia, l’inositolo è stato introdotto con successo nel campo dell’obesità e delle malattie metaboliche e continua ad attirare attenzioni grazie alla sua efficacia, alla semplicità di somministrazione, alla sicurezza e alla compliance.
[1] Wilkin TJ, Voss LD. Metabolic syndrome: maladaptation to a modern world. J R Soc Med 2004;97(11):511–20.
[2] Dinicola S, Unfer V, Facchinetti F, Soulage CO, Greene ND, Bizzarri M, Lagana` AS, Chan S-Y, Bevilacqua A, Pkhaladze L, Benvenga S, Stringaro A, Barbaro D, Appetecchia M, Aragona C, Bezerra Espinola MS, Cantelmi T, Cavalli P, Chiu TT, Wdowiak A. Inositols: from established knowledge to novel approaches. Int J Mol Sci 2021;22(19). https://doi.org/10.3390/ijms221910575.
[3] Nilsson PM, Tuomilehto J, Ryd_en L. The metabolic syndrome—what is it and how should it be managed? Eur J Prev Cardiol 2019;26(2_Suppl):33–46. ttps://doi.org/10.1177/2047487319886404.
[4] The Lancet Diabetes Endocrinology. Metabolic health: a priority for the post-pandemic era. Lancet Diabetes Endocrinol 2021;9(4):189. https://doi.org/10.1016/S2213-8587(21)00058-9.
[5] Khan MAB, Hashim MJ, King JK, Govender RD, Mustafa H, Al Kaabi J. Epidemiology of type 2 diabetes—global burden of disease and forecasted trends. J Epidemiol Global Health 2020;10 (1):107–11. https://doi.org/10.2991/jegh.k.191028.001.
[6] Kivimaki M, Kuosma E, Ferrie JE, Luukkonen R, Nyberg ST, Alfredsson L, Batty GD, Brunner EJ, Fransson E, Goldberg M, Knutsson A, Koskenvuo M, Nordin M, Oksanen T, Pentti J, Rugulies R, Shipley MJ, Singh-Manoux A, Steptoe A, Jokela M. Overweight, obesity, and risk of cardiometabolic multimorbidity: pooled analysis of individual-level data for 120 813 adults from 16 cohort studies from the USA and Europe. Lancet Public Health 2017;2(6):e277–85. https://doi.org/10.1016/S2468- 2667(17)30074-9.
[7] Ho FK, Celis-Morales C, Petermann-Rocha F, Parra-Soto SL, Lewsey J, Mackay D, Pell JP. Changes over 15years in the contribution of adiposity and smoking to deaths in England and Scotland. BMC Public Health 2021;21(1):169. https://doi.org/10.1186/s12889-021-10167-3.
[8] Steenblock C, Schwarz PEH, Ludwig B, Linkermann A, Zimmet P, Kulebyakin K, Tkachuk VA, Markov AG, Lehnert H, de Angelis MH, Rietzsch H, Rodionov RN, Khunti K, Hopkins D, Birkenfeld AL, Boehm B, Holt RIG, Skyler JS, DeVries JH, Bornstein SR. COVID-19 and metabolic disease: mechanisms and clinical management. Lancet Diabetes Endocrinol 2021;9(11):786–98. https://doi.org/10.1016/S2213-8587(21)00244-8.
[9] Denson JL, Gillet AS, Zu Y, Brown M, Pham T, Yoshida Y, Mauvais-Jarvis F, Douglas IS, Moore M, Tea K, Wetherbie A, Stevens R, Lefante J, Shaffer JG, Armaignac DL, Belden KA, Kaufman M, Heavner SF, Danesh VC, Kashyap R. Metabolic syndrome and acute respiratory distress syndrome in hospitalized patients with COVID-19. JAMA Netw Open 2021;4(12), e2140568. https://doi. org/10.1001/jamanetworkopen.2021.40568.
[10] O’Hearn M, Liu J, Cudhea F, Micha R, Mozaffarian D. Coronavirus disease 2019 hospitalizations attributable to cardiometabolic conditions in the United States: a comparative risk assessment analysis. J Am Heart Assoc 2021;10(5), e019259. https://doi.org/10.1161/JAHA.120.019259.
[11] Finkelstein EA, Trogdon JG, Cohen JW, Dietz W. Annual medical spending attributable to obesity: payer-and service-specific estimates. Health Affairs (Project Hope) 2009;28(5):w822–31. https://doi. org/10.1377/hlthaff.28.5.w822.
[12] American Diabetes Association. Economic costs of diabetes in the U.S. in 2017. Diabetes Care 2018;41(5):917–28. https://doi.org/10.2337/dci18-0007.
[13] Samuel VT, Shulman GI. Mechanisms for insulin resistance: common threads and missing links. Cell 2012;148(5):852–71. https://doi.org/10.1016/j.cell.2012.02.017
[14] Fox TE, Houck KL, O’Neill SM, Nagarajan M, Stover TC, Pomianowski PT, Unal O, Yun JK, Naides SJ, Kester M. Ceramide recruits and activates protein kinase C zeta (PKC zeta) within structured membrane microdomains. J Biol Chem 2007;282(17):12450–7.
[15] Boden G, Shulman GI. Free fatty acids in obesity and type 2 diabetes: defining their role in the development of insulin resistance and beta-cell dysfunction. Eur J Clin Investig 2002;32(Suppl 3):14–23.
[16] Hotamisligil GS, Shargill NS, Spiegelman BM. Adipose expression of tumor necrosis factor-alpha: direct role in obesity-linked insulin resistance. Science (New York, NY) 1993;259(5091):87–91.
[17] Plomgaard P, Fischer CP, Ibfelt T, Pedersen BK, van Hall G. Tumor necrosis factor-alpha modulates human in vivo lipolysis. J Clin Endocrinol Metab 2008;93(2):543–9.
[18] Matsuzawa Y, Funahashi T, Nakamura T. The concept of metabolic syndrome: contribution of visceral fat accumulation and its molecular mechanism. J Atheroscler Thromb 2011;18(8):629–39. [19] Mather KJ, Steinberg HO, Baron AD. Insulin resistance in the vasculature. J Clin Invest 2013;123
(3):1003–4. https://doi.org/10.1172/JCI67166.
[20] Tripathy D, Mohanty P, Dhindsa S, Syed T, Ghanim H, Aljada A, Dandona P. Elevation of free fatty acids induces inflammation and impairs vascular reactivity in healthy subjects. Diabetes 2003;52 (12):2882–7.
[21] da Silva AA, do Carmo JM, Li X, Wang Z, Mouton AJ, Hall JE. Role of hyperinsulinemia and insulin resistance in hypertension: metabolic syndrome revisited. Can J Cardiol 2020;36(5):671–82. https:// doi.org/10.1016/j.cjca.2020.02.066.
[22] Toh S-A, Rader DJ. Dyslipidemia in insulin resistance: clinical challenges and adipocentric therapeutic frontiers. Expert Rev Cardiovasc Ther 2008;6(7):1007–22. https://doi.org/ 10.1586/14779072.6.7.1007.
[23] Saltiel AR. Insulin signaling in health and disease. J Clin Invest 2021;131(1). https://doi.org/10.1172/ JCI142241.
[24] Eboue-Bonis D, Chambaut AM, Volfin P, Clauser H. Selective action of N-ethylmaleimide on insulin stimulation of metabolism in the surviving diaphragm. Bull Soc Chim Biol 1967;49(4):415–31. [25] Huijing F, Nuttall FQ, Villar-Palasi C, Larner J. UDPglucose: alpha-I,4-glucan alpha-4- glucosyltransferase in heart regulation of the activity of the transferase in vivo and in vitro in rat. A dissociation in the action of insulin on transport and on transferase conversion. Biochim Biophys Acta 1969;177(2):204–12.
[26] Stra°lfors P. Insulin second messengers. BioEssays 1997;19(4):327–35.
[27] Larner J, Brautigan DL, Thorner MO. D-chiro-inositol glycans in insulin signaling and insulin resistance. Mol Med (Cambridge, Mass) 2010;16(11–12):543–52. https://doi.org/10.2119/ molmed.2010.00107.
[28] Jones DR, Varela-Nieto I. The role of glycosyl-phosphatidylinositol in signal transduction. Int J Biochem Cell Biol 1998;30(3):313–26.
[29] Caro HN, Kunjara S, Rademacher TW, Leo´n Y, Jones DR, Avila MA, Varela-Nieto I. Isolation and partial characterisation of insulin-mimetic inositol phosphoglycans from human liver. Biochem Mol Med 1997;61(2):214–28.
[30] Larner J, Price JD, Heimark D, Smith L, Rule G, Piccariello T, Fonteles MC, Pontes C, Vale D, Huang L. Isolation, structure, synthesis, and bioactivity of a novel putative insulin mediator. A galactosamine chiro-inositol pseudo-disaccharide Mn2+ chelate with insulin-like activity. J Med Chem 2003;46(15):3283–91.
[31] Lilley K, Zhang C, Villar-Palasi C, Larner J, Huang L. Insulin mediator stimulation of pyruvate dehydrogenase phosphatases. Arch Biochem Biophys 1992;296(1):170–4.
[32] Varela I, Alvarez JF, Clemente R, Ruiz-Albusac JM, Mato JM. Asymmetric distribution of the phosphatidylinositol-linked phospho-oligosaccharide that mimics insulin action in the plasma membrane. Eur J Biochem 1990;188(2):213–8.
[33] Alvarez JF, Sa´nchez-Arias JA, Guadan˜o A, Est_evez F, Varela I, Felı´u JE, Mato JM. Transport in isolated rat hepatocytes of the phospho-oligosaccharide that mimics insulin action. Effects of adrenalectomy and glucocorticoid treatment. Biochem J 1991;274(Pt 2):369–74.
[34] Brautigan DL, Brown M, Grindrod S, Chinigo G, Kruszewski A, Lukasik SM, Bushweller JH, Horal M, Keller S, Tamura S, Heimark DB, Price J, Larner AN, Larner J. Allosteric activation of protein phosphatase 2C by D-chiro-inositol-galactosamine, a putative mediator mimetic of insulin action. Biochemistry 2005;44(33):11067–73.
[35] Yoshizaki T, Maegawa H, Egawa K, Ugi S, Nishio Y, Imamura T, Kobayashi T, Tamura S, Olefsky JM, Kashiwagi A. Protein phosphatase-2C alpha as a positive regulator of insulin sensitivity through direct activation of phosphatidylinositol 3-kinase in 3T3-L1 adipocytes. J Biol Chem 2004;279 (21):22715–26.
[36] Larner J, Huang LC, Suzuki S, Tang G, Zhang C, Schwartz CF, Romero G, Luttrell L, Kennington AS. Insulin mediators and the control of pyruvate dehydrogenase complex. Ann N Y Acad Sci 1989;573:297–305.
[37] McLean P, Kunjara S, Greenbaum AL, Gumaa K, Lo´pez-Prados J, Martin-Lomas M, Rademacher TW. Reciprocal control of pyruvate dehydrogenase kinase and phosphatase by inositol phosphoglycans. Dynamic state set by “push-pull” system. J Biol Chem 2008;283(48):33428–36. https://doi.org/ 10.1074/jbc.M801781200.
[38] Goel M, Azev VN, d’Alarcao M. The biological activity of structurally defined inositol glycans. Future Med Chem 2009;1(1):95–118.
[39] Hecht M-L, Tsai Y-H, Liu X, Wolfrum C, Seeberger PH. Synthetic inositol phosphoglycans related to GPI lack insulin-mimetic activity. ACS Chem Biol 2010;5(11):1075–86. https://doi.org/10.1021/ cb1002152.
[40] Chakraborty A, Koldobskiy MA, Bello NT, Maxwell M, Potter JJ, Juluri KR, Maag D, Kim S, Huang AS, Dailey MJ, Saleh M, Snowman AM, Moran TH, Mezey E, Snyder SH. Inositol pyrophosphates inhibit Akt signaling, thereby regulating insulin sensitivity and weight gain. Cell 2010;143(6):897–910. https://doi.org/10.1016/j.cell.2010.11.032.
[41] Lazarenko R, Geisler J, Bayliss D, Larner J, Li C. D-chiro-inositol glycan stimulates insulin secretion in pancreatic β cells. Mol Cell Endocrinol 2014;387(1–2):1–7. https://doi.org/10.1016/j.
mce.2014.02.004.
[42] Illies C, Gromada J, Fiume R, Leibiger B, Yu J, Juhl K, Yang S-N, Barma DK, Falck JR, Saiardi A, Barker CJ, Berggren P-O. Requirement of inositol pyrophosphates for full exocytotic capacity in pancreatic beta cells. Science (New York, NY) 2007;318(5854):1299–302.
[43] Croze ML, Soulage CO. Potential role and therapeutic interests of myo-inositol in metabolic diseases. Biochimie 2013;95(10):1811–27. https://doi.org/10.1016/j.biochi.2013.05.011.
[44] Ortmeyer HK, Bodkin NL, Lilley K, Larner J, Hansen BC. Chiroinositol deficiency and insulin resistance. I. Urinary excretion rate of chiroinositol is directly associated with insulin resistance in spontaneously diabetic rhesus monkeys. Endocrinology 1993;132(2):640–5.
[45] Ortmeyer HK, Huang LC, Zhang L, Hansen BC, Larner J. Chiroinositol deficiency and insulin resistance. II. Acute effects of D-chiroinositol administration in streptozotocin-diabetic rats, normal rats given a glucose load, and spontaneously insulin-resistant rhesus monkeys. Endocrinology 1993;132 (2):646–51.
[46] Croze ML, Vella RE, Pillon NJ, Soula HA, Hadji L, Guichardant M, Soulage CO. Chronic treatment with myo-inositol reduces white adipose tissue accretion and improves insulin sensitivity in female mice. J Nutr Biochem 2013;24(2):457–66. https://doi.org/10.1016/j.jnutbio.2012.01.008.
[47] Dang NT, Mukai R, Yoshida K-I, Ashida H. D-pinitol and myo-inositol stimulate translocation of glucose transporter 4 in skeletal muscle of C57BL/6 mice. Biosci Biotechnol Biochem 2010;74 (5):1062–7.
[48] Plows JF, Budin F, Andersson RAM, Mills VJ, Mace K, Davidge ST, Vickers MH, Baker PN, Silva- Zolezzi I, Stanley JL. The effects of myo-inositol and B and D vitamin supplementation in the db/+ mouse model of gestational diabetes mellitus. Nutrients 2017;9(2). https://doi.org/10.3390/ nu9020141.
[49] Chukwuma CI, Ibrahim MA, Islam MS. Myo-inositol inhibits intestinal glucose absorption and promotes muscle glucose uptake: a dual approach study. J Physiol Biochem 2016;72(4):791–801. [50] Antony PJ, Gandhi GR, Stalin A, Balakrishna K, Toppo E, Sivasankaran K, Ignacimuthu S, Al-Dhabi
NA. Myoinositol ameliorates high-fat diet and streptozotocin-induced diabetes in rats through promoting insulin receptor signaling. Biomed Pharmacother 2017;88:1098–113. https://doi.org/10.1016/j.biopha.2017.01.170.
[51] D’Oria R, Laviola L, Giorgino F, Unfer V, Bettocchi S, Scioscia M. PKB/Akt and MAPK/ERK phosphorylation is highly induced by inositols: novel potential insights in endothelial dysfunction in preeclampsia. Pregnancy Hypertens 2017;10:107–12. https://doi.org/10.1016/j. preghy.2017.07.001.
[52] Zhang Y, Li C, Zhang W, Zheng X, Chen X. Decreased insulin resistance by myo-inositol is associated with suppressed interleukin 6/phospho-STAT3 signaling in a rat polycystic ovary syndrome model. J Med Food 2020;23(4):375–87. https://doi.org/10.1089/jmf.2019.4580.
[53] Castillo P, Palou M, Otero D, Nu´n˜ez P, Palou A, Pico´ C. Sex-specific effects of myo-inositol ingested during lactation in the improvement of metabolic health in adult rats. Mol Nutr Food Res 2021;65 (11), e2000965. https://doi.org/10.1002/mnfr.202000965.
[54] Greene DA, De Jesus PV, Winegrad AI. Effects of insulin and dietary myoinositol on impaired peripheral motor nerve conduction velocity in acute streptozotocin diabetes. J Clin Invest 1975;55
(6):1326–36.
[55] Croze ML, G_eloe¨n A, Soulage CO. Abnormalities in myo-inositol metabolism associated with type 2 diabetes in mice fed a high-fat diet: benefits of a dietary myo-inositol supplementation. Br J Nutr 2015;113(12):1862–75. https://doi.org/10.1017/S000711451500121X.
[56] Asplin I, Galasko G, Larner J. Chiro-inositol deficiency and insulin resistance: a comparison of the chiro-inositol- and the myo-inositol-containing insulin mediators isolated from urine, hemodialysate, and muscle of control and type II diabetic subjects. Proc Natl Acad Sci U S A 1993;90(13):5924–8.
[57] Larner J. D-chiro-inositol in insulin action and insulin resistance-old-fashioned biochemistry still at work. IUBMB Life 2001;51(3):139–48.
[58] Larner J. D-chiro-inositol—its functional role in insulin action and its deficit in insulin resistance. Int J Exp Diabetes Res 2002;3(1):47–60.
[59] Fonteles MC, Huang LC, Larner J. Infusion of pH 2.0 D-chiro-inositol glycan insulin putative mediator normalizes plasma glucose in streptozotocin diabetic rats at a dose equivalent to insulin without inducing hypoglycaemia. Diabetologia 1996;39(6):731–4.
[60] Fonteles MC, Almeida MQ, Larner J. Antihyperglycemic effects of 3-O-methyl-D-chiro-inositol and D-chiro-inositol associated with manganese in streptozotocin diabetic rats. Hormone Metab Res
2000;32(4):129–32.
[61] Gao Y-F, Zhang M-N, Wang T-X, Wu T-C, Ai R-D, Zhang Z-S. Hypoglycemic effect of D- chiroinositol in type 2 diabetes mellitus rats through the PI3K/Akt signaling pathway. Mol Cell Endocrinol 2016;433:26–34. https://doi.org/10.1016/j.mce.2016.05.013.
[62] Yao Y, Shan F, Bian J, Chen F, Wang M, Ren G. D-chiro-inositol-enriched tartary buckwheat bran extract lowers the blood glucose level in KK-Ay mice. J Agric Food Chem 2008;56(21):10027–31. https://doi.org/10.1021/jf801879m.
[63] Cheng F, Yun S-J, Cao J-L, Chang M-C, Meng J-L, Liu J-Y, Cheng Y-F, Feng C-P. Differential gene expression and biological analyses of primary hepatocytes following D-chiro-inositol supplement. Front Endocrinol 2021;12, 700049. https://doi.org/10.3389/fendo.2021.700049.
[64] Fan C, Liang W, Wei M, Gou X, Han S, Bai J. Effects of D-chiro-inositol on glucose metabolism in db/db mice and the associated underlying mechanisms. Front Pharmacol 2020;11:354. https://doi. org/10.3389/fphar.2020.00354.
[65] Cheng F, Han L, Xiao Y, Pan C, Li Y, Ge X, Zhang Y, Yan S, Wang M. d-chiro-inositol ameliorates high fat diet-induced hepatic steatosis and insulin resistance via PKCε-PI3K/AKT pathway. J Agric Food Chem 2019;67(21):5957–67. https://doi.org/10.1021/acs.jafc.9b01253.
[66] Medina-Vera D, Navarro JA, Tovar R, Rosell-Valle C, Guti_errez-Adan A, Ledesma JC, Sanjuan C, Pavo´n FJ, Baixeras E, Rodrı´guez de Fonseca F, Decara J. Activation of PI3K/Akt signaling pathway in rat hypothalamus induced by an acute oral administration of D-pinitol. Nutrients 2021;13(7). https://doi.org/10.3390/nu13072268.
[67] Silva Ju´nior JAD, Silva ACVFD, Figueiredo LS, Araujo TR, Freitas IN, Carneiro EM, Ribeiro ES, Ribeiro RA. D-Pinitol increases insulin secretion and regulates hepatic lipid metabolism in Msg-Obese mice. An Acad Bras Cienc 2020;92(4), e20201382. https://doi.org/10.1590/0001-3765202020201382.
[68] Navarro JA, Decara J, Medina-Vera D, Tovar R, Suarez J, Pavo´n J, Serrano A, Vida M, Gutierrez- Adan A, Sanjuan C, Baixeras E, de Fonseca FR. Is an Orally active natural inositol that reduces pancreas insulin secretion and increases circulating ghrelin levels in Wistar rats. Nutrients 2020;12(7). https://doi.org/10.3390/nu12072030.
[69] Bray GA, Heisel WE, Afshin A, Jensen MD, Dietz WH, Long M, Kushner RF, Daniels SR, Wadden TA, Tsai AG, Hu FB, Jakicic JM, Ryan DH, Wolfe BM, Inge TH. The science of obesity management: an endocrine society scientific statement. Endocr Rev 2018;39(2):79–132. https://doi. org/10.1210/er.2017-00253.
[70] Chatree S, Thongmaen N, Tantivejkul K, Sitticharoon C, Vucenik I. Role of inositols and inositol phosphates in energy metabolism. Molecules (Basel Switzerland) 2020;25(21). https://doi.org/ 10.3390/molecules25215079.
[71] Bhandari R, Juluri KR, Resnick AC, Snyder SH. Gene deletion of inositol hexakisphosphate kinase 1 reveals inositol pyrophosphate regulation of insulin secretion, growth, and spermiogenesis. Proc Natl Acad Sci U S A 2008;105(7):2349–53. https://doi.org/10.1073/pnas.0712227105.
[72] Rajasekaran SS, Kim J, Gaboardi G-C, Gromada J, Shears SB, Dos Santos KT, Nolasco EL, de Ferreira S, Illies C, K€ohler M, Gu C, Ryu SH, Martins JO, Dare` E, Barker CJ, Berggren P-O. Inositol hexakisphosphate kinase 1 is a metabolic sensor in pancreatic β-cells. Cell Signal 2018;46:120–8. https://doi.org/10.1016/j.cellsig.2018.03.001.
[73] Longo M, Zatterale F, Naderi J, Parrillo L, Formisano P, Raciti GA, Beguinot F, Miele C. Adipose tissue dysfunction as determinant of obesity-associated metabolic complications. Int J Mol Sci 2019;20 (9). https://doi.org/10.3390/ijms20092358.
[74] Montt-Guevara MM, Finiguerra M, Marzi I, Fidecicchi T, Ferrari A, Genazzani AD, Simoncini T. D-Chiro-inositol regulates insulin signaling in human adipocytes. Front Endocrinol 2021;12, 660815.
https://doi.org/10.3389/fendo.2021.660815.
[75] Zhu Q, Ghoshal S, Tyagi R, Chakraborty A. Global IP6K1 deletion enhances temperature modulated energy expenditure which reduces carbohydrate and fat induced weight gain. Mol Metab 2017;6 (1):73–85. https://doi.org/10.1016/j.molmet.2016.11.010.
[76] Zhu Q, Ghoshal S, Rodrigues A, Gao S, Asterian A, Kamenecka TM, Barrow JC, Chakraborty A. Adipocyte-specific deletion of Ip6k1 reduces diet-induced obesity by enhancing AMPK-mediated thermogenesis. J Clin Invest 2016;126(11):4273–88. https://doi.org/10.1172/JCI85510.
[77] Muscogiuri G, Cantone E, Cassarano S, Tuccinardi D, Barrea L, Savastano S, Colao A. Gut microbiota: a new path to treat obesity. Int J Obes Suppl 2019;9(1):10–9. https://doi.org/10.1038/s41367-019-0011-7.
[78] Scheithauer TPM, Rampanelli E, Nieuwdorp M, Vallance BA, Verchere CB, van Raalte DH, Herrema H. Gut microbiota as a trigger for metabolic inflammation in obesity and type 2 diabetes. Front Immunol 2020;11, 571731. https://doi.org/10.3389/fimmu.2020.571731.
[79] Caputo M, Bona E, Leone I, Sama` MT, Nuzzo A, Ferrero A, Aimaretti G, Marzullo P, Prodam F. Inositols and metabolic disorders: from farm to bedside. J Tradit Complement Med 2020;10(3):252–9. https://doi.org/10.1016/j.jtcme.2020.03.005.
[80] Okazaki Y, Sekita A, Katayama T. Intake of phytic acid and myo-inositol lowers hepatic lipogenic gene expression and modulates gut microbiota in rats fed a high-sucrose diet. Biomed Rep 2018;8 (5):466–74. https://doi.org/10.3892/br.2018.1079.
[81] Le Donne M, Metro D, Alibrandi A, Papa M, Benvenga S. Effects of three treatment modalities (diet, myoinositol or myoinositol associated with D-chiro-inositol) on clinical and body composition outcomes in women with polycystic ovary syndrome. Eur Rev Med Pharmacol Sci 2019;23 (5):2293– 01. https://doi.org/10.26355/eurrev_201903_17278.
[82] Bevilacqua A, Bizzarri M. Inositols in insulin signaling and glucose metabolism. Int J Endocrinol 2018;2018:1968450. https://doi.org/10.1155/2018/1968450.
[83] Carlomagno G, Unfer V, Roseff S. The D-chiro-inositol paradox in the ovary. Fertil Steril 2011;95 (8):2515–6. https://doi.org/10.1016/j.fertnstert.2011.05.027.
[84] Bevilacqua A, Dragotto J, Giuliani A, Bizzarri M. Myo-inositol and D-chiro-inositol (40:1) reverse histological and functional features of polycystic ovary syndrome in a mouse model. J Cell Physiol 2019;234(6):9387–98. https://doi.org/10.1002/jcp.27623.
[85] Facchinetti F, Appetecchia M, Aragona C, Bevilacqua A, Bezerra Espinola MS, Bizzarri M, D’Anna R, Dewailly D, Diamanti-Kandarakis E, Herna´ndez Marı´n I, Kamenov ZA, Kandaraki E, Lagana` AS, Monastra G, Montanino Oliva M, Nestler JE, Orio F, Ozay AC, Papalou O, Unfer V. Experts’ opinion on inositols in treating polycystic ovary syndrome and noninsulin dependent diabetes mellitus: a further help for human reproduction and beyond. Expert Opin Drug Metab Toxicol 2020;16 (3):255–74. https://doi.org/10.1080/17425255.2020.1737675.
[86] Jeon Y, Aja S, Ronnett GV, Kim E-K. D-chiro-inositol glycan reduces food intake by regulating hypothalamic neuropeptide expression via AKT-FoxO1 pathway. Biochem Biophys Res Commun 2016;470(4):818–23. https://doi.org/10.1016/j.bbrc.2016.01.115.
[87] Pintaudi B, Di Vieste G, Bonomo M. The effectiveness of myo-inositol and D-chiro inositol treatment in type 2 diabetes. Int J Endocrinol 2016;2016:9132052.
[88] Min˜ambres I, Cuixart G, Gonc¸alves A, Corcoy R. Effects of inositol on glucose homeostasis: systematic review and meta-analysis of randomized controlled trials. Clin Nutr (Edinburgh, Scotland) 2019;38(3):1146–52. https://doi.org/10.1016/j.clnu.2018.06.957.
[89] Sharma I, Tupe RS, Wallner AK, Kanwar YS. Contribution of myo-inositol oxygenase in AGE: RAGE-mediated renal tubulointerstitial injury in the context of diabetic nephropathy. Am J Physiol Ren Physiol 2018;314(1):F107–21. https://doi.org/10.1152/ajprenal.00434.2017.
[90] D’Anna R, Corrado F, Loddo S, Gullo G, Giunta L, Di Benedetto A. Myoinositol plus α-lactalbumin supplementation, insulin resistance and birth outcomes in women with gestational diabetes mellitus: a randomized, controlled study. Sci Rep 2021;11(1):8866. https://doi.org/10.1038/s41598-021-88329-x.
[91] Adiels M, Olofsson S-O, Taskinen M-R, Bor_en J. Overproduction of very low-density lipoproteins is the hallmark of the dyslipidemia in the metabolic syndrome. Arterioscler Thromb Vasc Biol 2008;28 (7):1225–36. https://doi.org/10.1161/ATVBAHA.107.160192.
[92] Kaze AD, Santhanam P, Musani SK, Ahima R, Echouffo-Tcheugui JB. Metabolic dyslipidemia and cardiovascular outcomes in type 2 diabetes mellitus: findings from the look AHEAD study. J Am Heart
Assoc 2021;10(7), e016947. https://doi.org/10.1161/JAHA.120.016947.
[93] Giordano D, Corrado F, Santamaria A, Quattrone S, Pintaudi B, Di Benedetto A, D’Anna R. Effects
of myo-inositol supplementation in postmenopausal women with metabolic syndrome: a perspective, randomized, placebo-controlled study. Menopause (New York, NY) 2011;18(1):102–4. https://doi.org/10.1097/gme.0b013e3181e8e1b1.
[94] Kim J-I, Kim JC, Kang M-J, Lee M-S, Kim J-J, Cha I-J. Effects of pinitol isolated from soybeans on glycaemic control and cardiovascular risk factors in Korean patients with type II diabetes mellitus: a randomized controlled study. Eur J Clin Nutr 2005;59(3):456–8.
[95] Tabrizi R, Ostadmohammadi V, Lankarani KB, Peymani P, Akbari M, Kolahdooz F, Asemi Z. The effects of inositol supplementation on lipid profiles among patients with metabolic diseases: a systematic review and meta-analysis of randomized controlled trials. Lipids Health Dis 2018;17(1):123. https://doi.org/10.1186/s12944-018-0779-4.
[96] Unfer V, Facchinetti F, Orru` B, Giordani B, Nestler J. Myo-inositol effects in women with PCOS: a meta-analysis of randomized controlled trials. Endocr Connect 2017;6(8):647–58. https://doi.org/
10.1530/EC-17-0243.
[97] Costantino D, Minozzi G, Minozzi E, Guaraldi C. Metabolic and hormonal effects of myo-inositol in women with polycystic ovary syndrome: a double-blind trial. Eur Rev Med Pharmacol Sci 2009;13
(2):105–10.
[98] Shokrpour M, Foroozanfard F, Afshar Ebrahimi F, Vahedpoor Z, Aghadavod E, Ghaderi A, Asemi Z. Comparison of myo-inositol and metformin on glycemic control, lipid profiles, and gene expression related to insulin and lipid metabolism in women with polycystic ovary syndrome: a randomized controlled clinical trial. Gynecol Endocrinol 2019;35(5):406–11. https://doi.org/
10.1080/09513590.2018.1540570.
[99] Ruissen MM, Mak AL, Beuers U, Tushuizen ME, Holleboom AG. Nonalcoholic fatty liver disease: a multidisciplinary approach towards a cardiometabolic liver disease. Eur J Endocrinol 2020;183(3):
R57–73. .
[100] Pani A, Giossi R, Menichelli D, Fittipaldo VA, Agnelli F, Inglese E, Romandini A, Roncato R, Pintaudi B, Del Sole F, Scaglione F. Inositol and nonalcoholic fatty liver disease: a systematic review on deficiencies and supplementation. Nutrients 2020;12(11). https://doi.org/10.3390/nu12113379.
[101] Lee E, Lim Y, Kwon SW, Kwon O. Pinitol consumption improves liver health status by reducing
oxidative stress and fatty acid accumulation in subjects with nonalcoholic fatty liver disease: a randomized, double-blind, placebo-controlled trial. J Nutr Biochem 2019;68:33–41. https://doi.org/
10.1016/j.jnutbio.2019.03.006.
Articoli in evidenza
Infezioni vaginali o vaginiti: cause e sintomi
Le statistiche dimostrano che le infezioni vaginali colpiscono ogni donna almeno una volta nella vita. L’apparato genitale femminile è dotato di meccanismi difensivi capace di proteggerlo dall’attacco di microrganismi patogeni.
Menopausa: sintomi, disturbi e rimedi
La menopausa è una fase fisiologica della vita della donna che corrisponde alla cessazione della funzione ovarica, ovvero al termine del ciclo mestruale e dell’età fertile.
Seno denso: rischi e rimedi
Alle donne con età vicina o superiore ai 40 anni, viene consigliato di ripetere l’esame mammografico ogni 1/2 anni in base alla storia familiare, per rintracciare eventuali cambiamenti nei tessuti. Infatti, monitorando lo stato di salute del seno, si può intervenire tempestivamente nei casi di diagnosi tumorale.