Ali Cenk Ozay a, Scott Roseffb,c, e Shiao-yng Chan d,e
aDepartment of Obstetrics and Gynecology, Near East University, Research Center of Experimental Health Sciences, Near East University Hospital, Nicosia, Cyprus
bSouth Florida Institute for Reproductive Medicine—IVFMD, Boca Raton, FL, United States
cClinical Assistant Professor, Reproductive Endocrinology & Infertility, Department of Clinical Sciences, Division of Obstetrics and Gynecology, Dr. Kiran C. Patel College of Allopathic Medicine-Nova Southeastern University MD, Ft. Lauderdale, FL, United States
dDepartment of Obstetrics and Gynaecology, Yong Loo Lin School of Medicine, National University of Singapore, Singapore
eSingapore Institute for Clinical Sciences, Agency for Science, Technology and Research, Singapore, Singapore
Introduzione
Adattamento materno alla gravidanza
Resistenza all’insulina e diabete gestazionale
Sistema cardiovascolare e preeclampsia
Il metabolismo e la mobilizzazione dei lipidi
Il ruolo della placenta come regolatore dello scambio di nutrienti e scarti tra madre e feto e come mezzo di comunicazione materno-fetale
La placenta come regolatrice dello scambio materno-fetale di nutrienti e scarti
La circolazione nella placenta
Diffusione di ossigeno e anidride carbonica attraverso la barriera placentare
Trasporto di nutrienti attraverso la placenta
Trasporto di glucosio
Trasporto di aminoacidi
Trasporto di acidi grassi
Trasporto di Na, K, Cl e calcio
La placenta come mediatrice della comunicazione materno-fetale attraverso le vescicole extracellulari
Metabolismo e passaggio dell’inositolo attraverso l’asse materno-placento-fetale.
Inositoli nella regolazione della crescita e sviluppo fetale
Difetti del tubo neurale
Maturazione dei polmoni nel feto e disturbi respiratori neonatali
Crescita fetale e misura alla nascita
L’alterazione degli inositoli placentari nel (GDM) e nella preeclampsia potrebbe influenzare la crescita fetale
Conclusioni
Il ruolo critico degli inositoli e dei loro derivati nella regolazione della funzione ovarica e dell’ovulazione, così come nella funzionalità spermatica, è stato ampiamente studiato. Dopo la fecondazione, lo sviluppo della blastocisti e l’impianto, molti altri eventi altamente regolati devono verificarsi senza impedimenti durante il resto della gravidanza per garantire l’obiettivo finale della riproduzione umana: il parto di un bambino sano. Tuttavia, il ruolo dell’inositolo in molti di questi importanti eventi della gravidanza rimane poco compreso. In questo capitolo, riassumeremo le conoscenze attuali e, quando possibile, forniremo scenari probabili dell’implicazione dell’inositolo sulla base della nostra comprensione nei sistemi biologici correlati. Ci si aspetta che l’inositolo, essendo ubiquitario, svolga un ruolo in tutti e tre i compartimenti fisiologici della gravidanza: materno, placentare e fetale. Gli inositoli e i loro derivati sono coinvolti nell’alterazione della funzione dei tessuti materni per ottenere un ottimale adattamento materno, nella regolazione della funzione placentare, compresa la comunicazione materno-fetale, e nella modulazione della crescita e dello sviluppo fetale.
Gli adattamenti in tutti i sistemi fisiologici materni sono necessari al fine di sostenere la crescita e lo sviluppo sano del feto nell’utero e di preparare la prole per la vita extrauterina. Tali cambiamenti includono l’ampio aumento del volume di sangue materno, l’aumento del flusso sanguigno cardiaco, la vasodilatazione periferica, l’aumento della filtrazione e dell’escrezione renale, l’aumento della produzione degli ormoni tiroidei, l’alterazione della produzione epatica di proteine circolanti e fattori di coagulazione, l’immunosoppressione relativa per favorire la tolleranza immunitaria del concepito, un generale spostamento dalla immunoregolazione Th1 alla Th2, l’accumulo iniziale di lipidi nei tessuti seguito da una successiva mobilizzazione dei lipidi, l’aumento della resistenza all’insulina e della produzione di insulina, e molti altri. Essendo l’inositolo un componente chiave dei lipidi del fosfatidilinositolo che hanno importanti funzioni regolatrici nelle membrane cellulari, dei composti di segnalazione intracellulare come i fosfati di inositolo e delle proteine di segnalazione come i fosfoglicani di inositolo (IPG), l’inositolo svolge indubbiamente un ruolo centrale in tutti gli eventi dell’adattamento materno, ma i dettagli di questi devono ancora essere chiariti. Le interazioni tra l’inositolo e i derivati dell’inositolo con altri fattori endocrini e composti di segnalazione devono essere modulate per garantire un adattamento materno ottimale in gravidanza. Ovunque siano necessari spostamenti dell’omeostasi fisiologica, c’è sempre il potenziale sviluppo di condizioni patologiche e deviazioni nei processi di adattamento materno che possono portare a complicazioni della gravidanza. Sono già state descritte perturbazioni nelle concentrazioni circolanti e urinarie di inositolo materno nelle comuni complicazioni della gravidanza come il diabete gestazionale (GDM) e la preeclampsia, entrambe associate a un aumento della morbilità e mortalità materna e perinatale. L’idea che un processo disfunzionale nell’elaborazione dell’inositolo possa far parte dell’eziologia che porta allo sviluppo di queste complicazioni è supportata da prove circostanziali che mostrano come i cambiamenti nella regolazione dell’inositolo precedano la manifestazione clinica di queste complicazioni.
La gravidanza è uno stato fisiologicamente indotto di resistenza all’insulina per favorire la mobilitazione dei nutrienti al feto, ma uno stato esagerato di resistenza all’insulina porta al diabete gestazionale (GDM) [1]. Si è ipotizzato che il myo-inositolo favorisca la sensibilità all’insulina aumentando la disponibilità di fosfatidilinositolo e fosfati di inositolo per la segnalazione dei secondi messaggeri, compresa la fosforilazione da parte della fosfoinositide 3 chinasi (PI3K) nel pathway dell’insulina [2]. Il myo-inositolo (MI) e il D-chiro-inositolo (DCI) sono anche componenti dei derivati dell’inositolo, inibitore dell’inositolo fosfoglicano-chinasi AMP (IPG-A) e stimolatore del fosfato dell’inositolo fosfoglicano (IPG-P); entrambi sono presunti secondi messaggeri dell’insulina coinvolti rispettivamente nell’assorbimento del glucosio/lipogenesi e nella sintesi del glicogeno [3,4]. Si sa anche che gli IPG hanno un effetto diretto imitatore dell’insulina sui tessuti materni [5]. Si è ipotizzato che una relativa deplezione tissutale di inositolo, eventualmente attraverso un aumento dell’escrezione di inositolo, possa aumentare la vulnerabilità allo sviluppo del GDM. Infatti, uno studio ha riportato che le concentrazioni urinarie di MI e DCI erano significativamente più elevate nel primo trimestre di gravidanza nelle donne che successivamente hanno sviluppato il GDM rispetto ai controlli che non lo avevano sviluppato[6], suggerendo che un aumento dell’escrezione urinaria di inositolo e presunta deplezione di inositolo (che deve ancora essere dimostrata nei tessuti materni) precedono la manifestazione clinica del GDM e potrebbero svolgere un ruolo eziologico. Allo stesso modo, squilibri nel metabolismo dell’IPG possono alterare la segnalazione dell’insulina durante la gravidanza. Nel GDM, l’IPG-P urinario materno è aumentato e l’IPG-A è diminuito, ma il significato biologico preciso di ciò è sconosciuto [7,8]. Una spiegazione alternativa a tali osservazioni è che un’elevata escrezione urinaria di inositolo sia semplicemente un biomarcatore per le donne predisposte allo sviluppo del GDM, possibilmente un’associazione che è confusa dalla loro predisposizione genetica/microbioma o dallo stile di vita pre-gravidanza. Il sostegno al ruolo causale dell’inositolo nella patologia del GDM proviene da studi clinici sulla supplementazione materna di MI, come discusso nei capitoli precedenti, che hanno riportato una riduzione della glicemia gestazionale e dei tassi di GDM con la supplementazione a partire dalla fine del primo trimestre di gravidanza nelle donne a rischio di GDM [9]. Tuttavia, alcuni studi hanno riportato una mancanza di effetto [10,11], e ulteriori indagini sono necessarie per comprendere più chiaramente i meccanismi sottostanti il ruolo dell’inositolo nello sviluppo del GDM, in modo che il trattamento possa essere mirato alle popolazioni appropriate, e iniziato al momento giusto, per massimizzare i benefici.
La preeclampsia è una condizione caratterizzata da ipertensione di nuova insorgenza (o aggravamento di ipertensione preesistente) con significativa proteinuria o come un disturbo multi-sistemico, la cui base risiede nella malplacentazione e nella disfunzione endoteliale. È anche uno stato di aumentata resistenza insulinica, come nel GDM [12]. I livelli di una proteina specifica della gravidanza chiamata IPG-P nell’urina aumentano rapidamente nelle settimane precedenti alla manifestazione clinica della preeclampsia, suggerendo un ruolo eziologico [13,14]. Tuttavia, studi longitudinali che misurano l’IPG-P urinario dal primo trimestre in poi hanno dimostrato che questo mancava di specificità per prevedere in modo affidabile la preeclampsia [13,15], probabilmente a causa delle variazioni nell’assunzione dietetica recente che possono causare aumenti sporadici nei livelli di IPG-P urinario. Il fatto che l’IPG-P nel liquido amniotico sia aumentato anche nella preeclampsia e che le concentrazioni di IPG-P nei vasi ombelicali siano più elevate rispetto all’IPG-P circolante materno corrispondente, suggerisce che l’aumento dell’IPG-P materno urinario, placentare e nel liquido amniotico potrebbe essere di origine fetale [13,14]. Non è chiaro se l’inositolo o gli IPG abbiano un ruolo causale nello sviluppo della preeclampsia o se rappresentino semplicemente uno dei biomarcatori del processo patologico. Alcuni IPG-P hanno effetti simili all’insulina, quindi un aumento dell’IPG-P nell’urina materna, nella placenta e nel liquido amniotico potrebbe alterare la fisiologia materna [15,16], sebbene se questo sia protettivo o patologico è discutibile. Ad esempio, sono stati segnalati difetti nel signaling dipendente della fosfatidilinositolo 3-chinasi (PI3K) nello sviluppo della preeclampsia, nella disfunzione endoteliale e nella resistenza insulinica associata. I substrati del recettore insulinico placentare 1 e 2 dei pazienti con preeclampsia hanno mostrato un aumento della fosforilazione della serina, mentre l’attività della PI3K era diminuita [17], proprio come nel trattamento in vitro con inositolo in cellule endoteliali umane (HUVEC), che ha promosso la fosforilazione della Ser473 della proteina chinasi B (PKB/Akt). Questi risultati hanno suggerito che l’aumento dell’inositolo placentare nella preeclampsia potrebbe contrastare l’inattivazione del recettore del substrato dell’insulina [18,19]. Inoltre, la fosforilazione di MAPK placentare è aumentata nella preeclampsia, quando viene misurata dopo il parto, probabilmente a causa dell’aumento dell’inositolo placentare, e se la fosforilazione di MAPK fosse aumentata in modo simile in una fase precedente della gravidanza, ciò potrebbe aver compromesso l’invasione e la crescita del trofoblasto, causando una malplacentazione e lo sviluppo della preeclampsia [20,21].
Una metanalisi di studi clinici su adulti non gravidi ha suggerito che l’integrazione di inositolo potrebbe ridurre sia la pressione sistolica sia quella diastolica [22], forse attraverso la modulazione dell’inositolo della resistenza insulinica, dello stress ossidativo e dell’infiammazione, i quali sono noti per influenzare la pressione sanguigna e la funzione cardiovascolare. Tuttavia, fino ad oggi, gli studi clinici sull’integrazione di MI condotti su popolazioni di donne in gravidanza non hanno riportato cambiamenti nei tassi di preeclampsia o ipertensione indotta dalla gravidanza.
Ancora una volta, la mancanza di comprensione dei meccanismi sottostanti dell’effetto ostacola la nostra capacità di sfruttare potenzialmente l’inositolo come terapia per questa condizione.
All’inizio della gravidanza si verifica un aumento dell’accumulo di lipidi nei depositi adiposi, seguito successivamente dalla mobilizzazione dei lipidi nel secondo e terzo trimestre di gravidanza, nonché durante l’allattamento, al fine di aumentare l’apporto di nutrienti al feto in rapida crescita. Poiché gli inositoli e i loro derivati sono generalmente noti per regolare il metabolismo, la mobilizzazione, il trasporto e l’accumulo dei lipidi, in parte attraverso la regolazione di diversi enzimi chiave nelle vie lipidiche e nelle vie di segnalazione degli ormoni critici [23-25], ci si aspetta che gli inositoli siano coinvolti anche nella regolazione della mobilizzazione dei lipidi durante la gravidanza.
Infatti, l’integrazione di inositolo in popolazioni affette da malattie metaboliche, tra cui il diabete gestazionale, potrebbe ridurre i livelli circolanti di trigliceridi, nonché i livelli totali e di colesterolo LDL [26]. Nei modelli animali, l’integrazione di MI ha alterato la distribuzione dei lipidi nell’intero corpo e, in generale, ha aumentato l’accumulo di lipidi nei tessuti adiposi e ha ridotto l’accumulo di grasso ectopico nel fegato e in altre aree [27].
Tuttavia, non sono state fornite evidenze consistenti da modelli di roditori gravidi a sostegno di queste ipotesi. Ratti gravidi alimentati con una dieta povera di MI durante la gestazione e per 7 settimane dopo il parto hanno sviluppato il fegato grasso solo durante l’allattamento, e questi cambiamenti sono stati invertiti dal trattamento con inositolo o dalla cessazione dell’allattamento [28]. Si noti che la gestazione dei roditori termina in una fase equivalente al secondo trimestre della gravidanza umana, quindi non rappresenta i cambiamenti nella mobilizzazione dei lipidi che avvengono alla fine della gravidanza umana. Tuttavia, questo studio ha suggerito che la carenza di MI rende la madre più vulnerabile a un potenziale deposito di grasso ectopico patologico durante i periodi di aumentata mobilizzazione dei lipidi, come nel caso del fegato grasso che, a sua volta, aumenta la resistenza all’insulina. In uno studio separato su modello murino db/+ di diabete gestazionale, il trattamento con inositolo ha ridotto l’adipe intra-addominale, gonadico e perirenale nelle madri [29], ma in un modello murino di GDM con dieta ricca di grassi, il trattamento con inositolo non ha influenzato l’accrescimento del grasso materno o la glicemia [30].
Forse alcune sottopopolazioni di donne, a seconda delle loro specifiche vulnerabilità metaboliche sottostanti, potrebbero anche mobilizzare e metabolizzare i lipidi in modo diverso in risposta all’inositolo. Quest’area richiede ulteriori indagini.
Nonostante le limitazioni delle nostre conoscenze attuali, è chiaro che gli inositoli svolgono ruoli critici nell’orchestrazione dell’adattamento materno per sostenere una gravidanza di successo. È altrettanto importante comprendere i segnali che innescano la serie di cambiamenti che compongono l’adattamento materno, e questi segnali provengono dal concepito, principalmente dalla placenta.
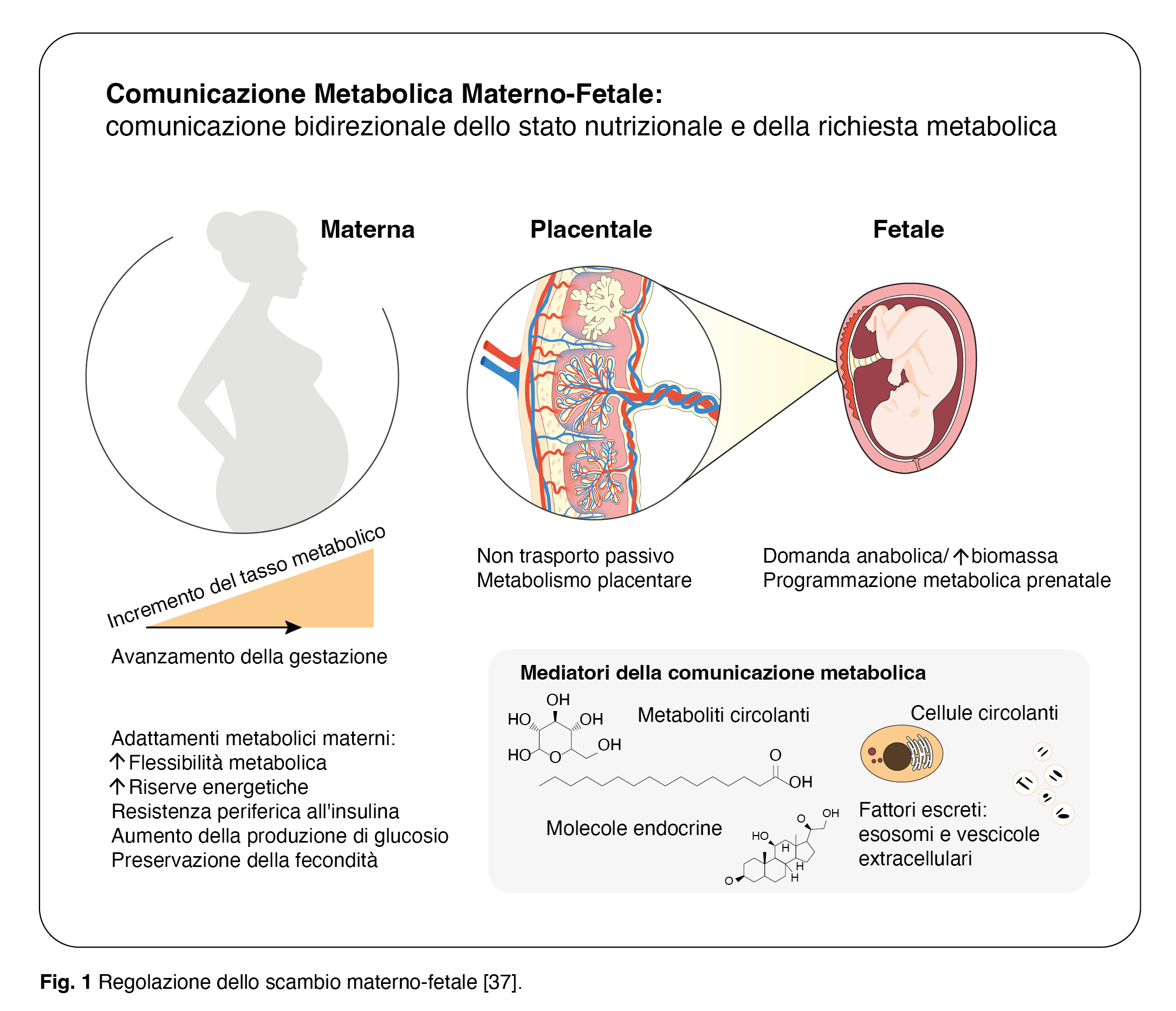
I processi che portano a una gravidanza senza complicazioni per la madre e a uno sviluppo intrauterino sano del feto richiedono una comunicazione coordinata a livello metabolico, ormonale e immunologico, e la placenta è il principale regolatore di questa relazione [31]. La placenta è classificata tradizionalmente come un organo di scambio di nutrienti e scarti tra madre e feto, ma ha anche funzioni comunicative molto importanti che vengono sempre più apprezzate (Fig. 1). Le esigenze dinamiche e i bisogni del feto in via di sviluppo con l’avanzare della gestazione richiedono una costante comunicazione madre-feto. La comunicazione bidirezionale madre-feto avviene attraverso la placenta in base allo stato nutrizionale e alla richiesta metabolica di entrambe le parti [32]. Metaboliti circolanti, composti endocrini, cellule circolanti e fattori secreti come esosomi e vescicole extracellulari possono contribuire a questa comunicazione. L’unità feto-placentare è ricca di inositolo e le concentrazioni di inositolo nel sangue fetale sono molto più elevate rispetto agli adulti [33-36]. Ciò suggerisce fortemente un’importanza fisiologica dell’inositolo nella funzione placentare, nello sviluppo fetale e, eventualmente, anche nella comunicazione madre-placenta-feto.
La placenta si sviluppa dalle interazioni tra il trofoblasto della blastocisti che si impianta e l’endometrio. La placenta è funzionalmente matura come organo di scambio entro le 10-12 settimane di gestazione, e una crescita significativa della placenta precede la normale accelerazione della crescita fetale, tanto che la placenta è più grande del feto fino alle 15-16 settimane di gestazione [38]. La dimensione e la capacità di trasporto della placenta sono spesso correlate con la salute e la crescita fetale. La placenta umana è emocoriale, ovvero il sangue materno entra in contatto diretto con lo sinciziotrofoblasto, la prima barriera allo scambio materno-fetale. Lo sinciziotrofoblasto specializzato ha una membrana microvillosa a contatto con il sangue materno e una membrana basale rivolta verso il sangue fetale. La placenta ha un’organizzazione a villi, in cui ogni villo corionico è composto da uno strato epiteliale di sinciziotrofoblasto e una rete vascolare fetale interna e tessuto connettivo stromale derivato dal mesoderma embrionale.
La placenta scambia una varietà di nutrienti, segnali endocrini, citochine e fattori di crescita, regolando così lo sviluppo intrauterino; si noti che questi fattori provengono sia dal feto sia dalla madre [31]. Come precedentemente affermato, lo sviluppo della placenta inizia con l’impianto della blastocisti nella cavità endometriale. Il processo di impianto consiste in tre fasi principali: apposizione, adesione e penetrazione. Durante tutto questo processo, a partire dallo stadio di zigote, la richiesta cellulare di MI e il suo assorbimento aumentano, con evidenze che suggeriscono che l’inositolo sia coinvolto nello sviluppo della blastocisti e nell’impianto [42]. In uno studio su embrioni di topo, è stato riportato che l’inositolo favoriva la proliferazione cellulare aumentando la fosforilazione di Akt [43].
L’effetto dell’inositolo sull’indice di impianto è stato anche studiato nell’uomo. Uno studio controllato randomizzato ha dimostrato un aumento significativo della qualità degli embrioni e dei tassi di impianto nel gruppo trattato con 4g di inositolo più 400µg di acido folico al giorno rispetto al gruppo di controllo che è stato integrato solo con acido folico [44].
Successivamente, allo stadio di blastocisti, le cellule si differenziano in linee cellulari diverse: l’embrioblasto e il trofoblasto. Gli embrioblasti formano l’embrione stesso, l’amnios, il sacco vitellino e l’allantoide, mentre il trofoblasto forma la placenta [45,46]. Il trofoblasto si differenzia in due diverse strutture cellulari. I citotrofoblasti sono cellule che si moltiplicano per formare lo sinciziotrofoblasto, che si trova sul lato materno [47]. Durante l’impianto, lo sinciziotrofoblasto costituisce l’interfaccia cellulare che si oppone direttamente all’endometrio (decidua), pronto ad accogliere l’embrione [48]. Lo sinciziotrofoblasto è altamente polarizzato e presenta due membrane plasmatiche: una microvillosa rivolta verso la madre (MVM) e una basale (BM) orientata verso la circolazione fetale per regolare lo scambio e la comunicazione materno-fetale [49].
I villi corionici contenenti una rete vascolare fetale interna rivestita da sinciziotrofoblasti sono immersi nel sangue materno, che viene costantemente rinnovato all’interno del letto placentare. Anidride carbonica e materiali di scarto nel sangue privo di ossigeno proveniente dal feto e che raggiunge i villi corionici placentari vengono scambiati con ossigeno e nutrienti provenienti dalla circolazione materna al fine di fornire al feto un sangue ricco di nutrienti. È importante sottolineare che la barriera placentare svolge un ruolo nella prevenzione della miscelazione del sangue fetale e materno. Per una gravidanza sana, è necessaria una circolazione placentare adeguata sia dal lato fetale che dal lato materno per facilitare uno scambio efficace. Sebbene non si comprenda completamente se l’inositolo abbia un ruolo nella regolazione della circolazione placentare, alcuni studi hanno riportato l’espressione di recettori per diversi derivati dell’inositolo, suggerendo che possa avere un ruolo. In modelli preclinici su roditori, i recettori inositolo trifosfato di tipo 1 (IP3R1) e di tipo 3 (IP3R3) sono stati localizzati nel labirinto placentare, nell’allantoide e nel sacco vitellino. In uno studio condotto da Uchida et al., è stato dimostrato che la vascolarizzazione extra embrionica della placenta era compromessa nei topi con una doppia delezione genetica (DKO) per i recettori inositolo trifosfato di tipo 1 e di tipo 3 [50]. Successivamente, Yang et al. hanno indagato sui recettori IP3R1 e IP3R2 (recettori di tipo 2 per l’inositolo trifosfato) in questi topi DKO e hanno osservato difetti allantoici-placentari come una riduzione della profondità del labirinto placentare e una riduzione delle dimensioni dei vasi ombelicali [51].
Gli studi non placentari hanno dimostrato che l’ipercapnia promuove la fosforilazione dell’enzima 1 alfa richiedente inositolo [52] e anche il cAMP con un meccanismo dipendente dal recettore IP3 [53]. Si afferma inoltre che l’inositolo esafosfato può influenzare l’affinità per l’ossigeno [54]. Sebbene questi studi presenti in letteratura non siano stati condotti sul trasporto e scambio gassoso placentare, suggeriscono un possibile ruolo dell’inositolo in questo contesto, e questa dovrebbe essere un’area di ricerca ulteriore, soprattutto nelle condizioni patologiche di restrizione della crescita intrauterina (che è stata associata ad un aumento degli IPG urinari neonatali).
Lo scambio attraverso la barriera sinciziotrofoblastica placentare integra può avvenire attraverso tre processi principali: diffusione, meccanismi mediati da trasportatori e endocitosi/esocitosi [55]. La diffusione di piccole molecole relativamente idrofobiche (come i gas respiratori attraverso la membrana plasmatica) avviene rapidamente. Al contrario, le molecole non liposolubili (idrofile) come il glucosio e gli aminoacidi, che non possono diffondere attraverso le membrane plasmatiche, necessitano di proteine trasportatrici [56]. L’endocitosi è il processo mediante il quale si formano invaginazioni sulla superficie cellulare apicale, si separano e poi si spostano più in profondità nel citoplasma [57]. Durante il primo trimestre, una serie di proteine di origine materna si accumula nei fluidi celomatici e amniotici, mentre più avanti nella gravidanza, l’immunoglobulina G (IgG) attraversa la placenta mediante questo meccanismo [58].
Il glucosio è la principale fonte di energia per il feto e la placenta. Tuttavia, la concentrazione plasmatica di glucosio fetale è più bassa rispetto al livello di glucosio circolante materno corrispondente. Il trasporto del glucosio placentare avviene attraverso la diffusione facilitata, principalmente tramite il trasportatore GLUT1 presente sia sul lato rivolto verso la madre (MVM) sia sulla membrana basale rivolta verso il feto (BM), e attraverso GLUT3 che si trova solo sul lato rivolto verso la madre (Fig. 2) [59–61].
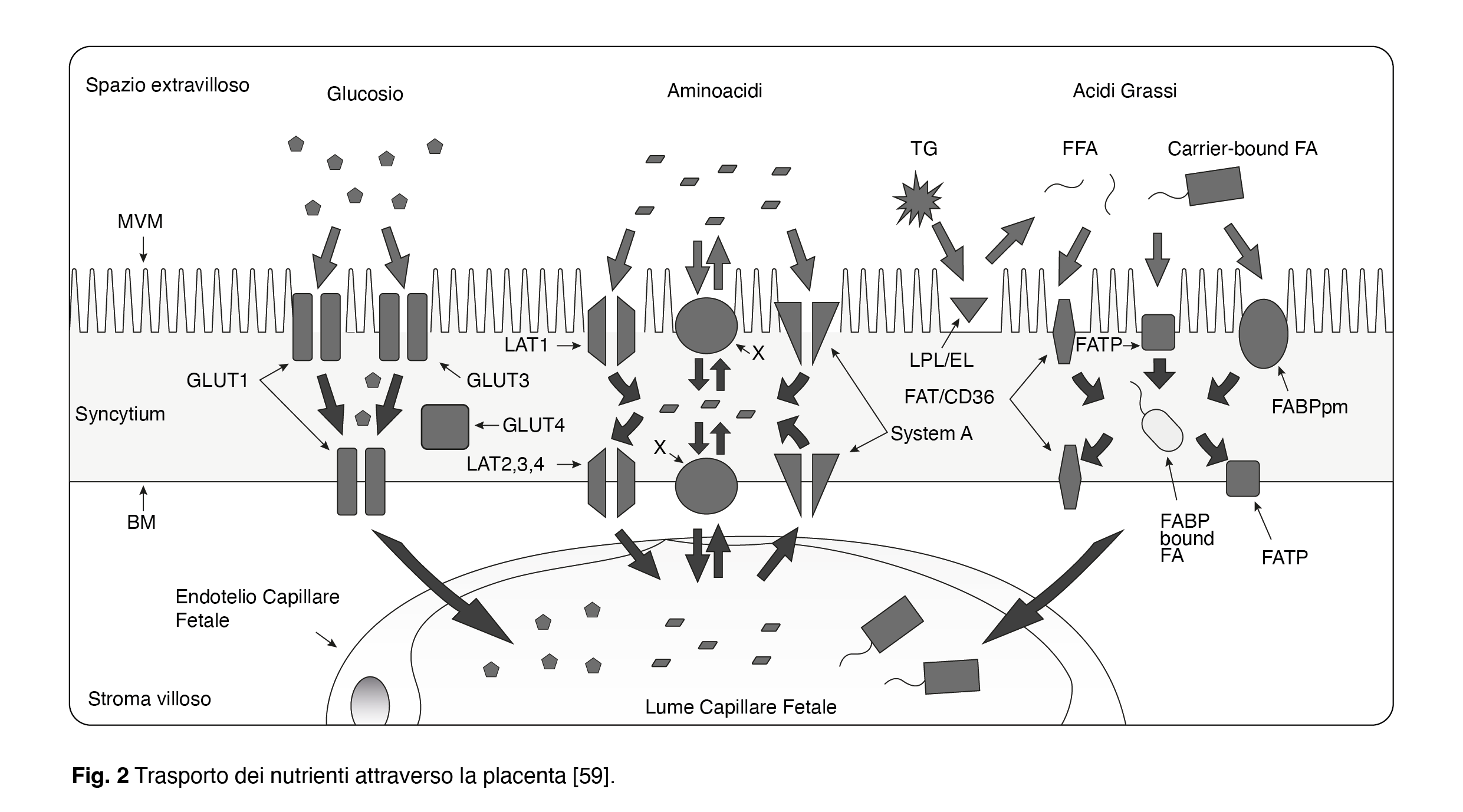
Nonostante l’assorbimento del glucosio placentare non dipenda dalla segnalazione dell’insulina (a differenza di altri tessuti), i derivati dell’inositolo possono comunque avere il potenziale per modulare il trasferimento del glucosio. Ad esempio, il fattore di crescita simile all’insulina (IGF), che utilizza componenti dell’inositolo nel suo percorso di segnalazione, potrebbe agire sulla placenta per influenzare il trasferimento di glucosio materno-fetale. Inoltre, durante il passaggio transplacentare del glucosio, circa il 30% viene utilizzato dalla placenta per il suo metabolismo al termine della gravidanza. È stato ipotizzato che livelli aumentati di IPG-P placentare, come descritto nella preeclampsia, possano stimolare la sintesi locale di glicogeno [62], in modo simile al fenomeno osservato nel fegato dove l’IPG-P potrebbe attivare la fosfatasi piruvato deidrogenasi, la fosfatasi glicogeno sintasi e l’aciltransferasi del glicerolo-3-fosfato [63]. Se ciò fosse dimostrato, potrebbe comportare un aumento dell’utilizzo/ritenzione del glucosio da parte della placenta, una ridotta fornitura di glucosio al feto e un aumento del rischio di ritardo di crescita e asfissia intrauterina, che sono condizioni associate alla preeclampsia.
Le concentrazioni di aminoacidi sono generalmente più elevate nel feto rispetto alla circolazione materna, suggerendo che la placenta medi il trasporto concentrato degli aminoacidi verso il feto. Nella placenta umana, il trasporto degli aminoacidi avviene attraverso 20 diversi sistemi di trasporto che si trovano sul lato rivolto verso la madre (MVM) e/o sul lato rivolto verso il feto (BM) della placenta, come ad esempio il sistema A (attività su MVM e BM; trasportatori SNAT1, SNAT2 e SNAT4) e il sistema L (attività su MVM e BM; trasportatori LAT1-4) [64-67] (Fig. 2) [59]. In uno studio che ha esaminato il trasporto di inositolo e aminoacidi, è stato dimostrato che il trasporto degli aminoacidi diminuiva nelle cellule KB carenti di inositolo [68]. Altri studi molecolari hanno fornito evidenze che i derivati dell’inositolo hanno un ruolo nel trasporto degli aminoacidi. Prendendo ad esempio mTOR (mammalian target of rapamycin), una proteina chinasi che media la sintesi proteica dagli aminoacidi [69], e mTORC1, un regolatore positivo del trasporto degli aminoacidi attraverso la placenta [70]; si sa che l’attività di mTORC è disregolata in complicanze della gravidanza come il ritardo della crescita fetale, e la multichinasi inositolo polifosfato (IPMK) modula la comunicazione degli aminoacidi con mTORC1 indipendentemente dalla sua funzione catalitica e sembra essere un cofattore fisiologico di mTORC [25,71].
Gli acidi grassi essenziali e gli acidi grassi polinsaturi a lunga catena (come l’acido docosaesaenoico, l’acido arachidonico e l’acido eicosapentaenoico) sono molto importanti durante lo sviluppo fetale come fonte di energia, per la formazione delle membrane cellulari e come precursori di importanti composti bioattivi (come prostacicline, prostaglandine, tromboxani e leucotrieni). Gli acidi grassi e i corpi chetonici attraversano le membrane plasmatiche placentari mediante meccanismi mediati dalle proteine, possibilmente insieme a una certa diffusione semplice. Diverse proteine identificate nella placenta sono ritenute principalmente responsabili di facilitare il trasporto lungo il gradiente di concentrazione: la proteina legante gli acidi grassi nella membrana plasmatica (FABPpm) e le proteine di trasferimento degli acidi grassi (FAT/CD36 e FATP1-6) [59,72,73] (Fig. 2). Il trasferimento materno-fetale degli acidi grassi è fortemente regolato dal metabolismo lipidico placentare [74]. Gli acidi grassi prelevati dalla circolazione materna vengono ampiamente metabolizzati dalla placenta in molte diverse specie di lipidi prima di essere trasferiti al feto. Il metabolismo lipidico placentare è regolato dall’inositolo e dai derivati dell’inositolo [36], con studi in vitro che suggeriscono un notevole effetto dell’inositolo agendo sugli eventi iniziali come il prelievo e l’attivazione degli acidi grassi, che potrebbe influenzare l’intera classe lipidica [75].
Ioni di potassio, sodio e cloruro attraversano la barriera placentare per diffusione attraverso canali proteici di membrana o sono co-regolati attraverso simtrasportatori di altri fattori. Infatti, due dei principali trasportatori dell’inositolo libero stesso, SMIT1 e SMIT2, sono simtrasportatori sodio-inositolo e entrambi sono espressi nella placenta umana. Inoltre, si sa che l’inositolo influisce sulla permeabilità dei canali ionici, il che potrebbe applicarsi anche al trasporto ionico placentare [76].
Il trasferimento placentare del calcio al feto in sviluppo è essenziale per la mineralizzazione ossea e l’accumulo fetale di calcio aumenta in modo esponenziale nell’ultimo trimestre di gravidanza. Il trasporto del calcio è stato modellato come comprendente tre fasi: (1) diffusione semplice dal plasma materno nel trofoblasto; (2) trasferimento attraverso il citoplasma del trofoblasto legato alla proteina di legame al calcio calbindina-D9k (CaBP9k); e (3) trasporto attivo nella circolazione fetale mediante la Ca2+ -ATPasi della membrana plasmatica [59,77]. Mentre il trifosfato di inositolo (IP3) consente il rilascio del calcio dall’organulo di stoccaggio intracellulare del reticolo endoplasmatico (ER), il tetrakisfosfato di inositolo (IP4) controlla l’ingresso del calcio nell’ER. Si ritiene che l’IP4 controlli la formazione di giunzioni di trasporto del calcio dipendenti dal GTP tra membrane [78,79]. Il metabolismo intracellulare di IP3- Ca2+ ha un ruolo molto importante nelle cellule e influenza attività vitali. I recettori stimolati in risposta all’agonista attivano la fosfolipasi C (PLC). Il diacilglicerolo (DAG) e l’IP3 si formano dal fosfatidilinositolo bifosfato (PIP2) che viene idrolizzato dalla PLC. L’IP3 si lega quindi al suo recettore per rilasciare Ca2+ .Il Ca2+ rilasciato attiva processi importanti come la fertilizzazione, la proliferazione, il metabolismo e la secrezione [80]. Pertanto, si può suggerire che l’inositolo abbia un effetto su tutte le vie intracellulari associate alla segnalazione del calcio all’interno della placenta.
In generale, il controllo dei livelli intracellulari di calcio è importante per la segnalazione del Ca2+ . Elevati livelli intracellulari di calcio mantenuti risultano in necrosi e apoptosi cellulare. In questo contesto, considerando l’effetto cruciale del trifosfato di inositolo nella via intracellulare del calcio, dovrebbe essere compresa anche la sua importanza nella regolazione dell’apoptosi placentare [81].
Infatti, la segnalazione del Ca2+ avviene in tutte le cellule e la sua interazione con l’inositolo si manifesta non solo nel processo di apoptosi, ma anche in tutte le attività vitali come l’espressione genica, la fertilizzazione, lo sviluppo e la secrezione [81]. Inoltre, è stato dimostrato in numerosi studi che diversi derivati dell’inositolo o recettori influenzano i processi di apoptosi-anti-apoptosi, compresi i linfociti T, le interleuchine e i fattori di crescita trasformativa [82-85]. Come affermato da Yang et al., è stato suggerito che un difetto del recettore IP3 influenzerà tutti i tessuti fetali e il mesoderma extraembrionale, portando a morte embrionale e difetti placentari. Inoltre, gli autori hanno concluso che i recettori IP3 svolgono un ruolo fondamentale nel preservare la comunicazione feto-materna e la vitalità fetale [51].
È stato dimostrato che il citotrofoblasto e il sinciziiotrofoblasto sono noti mediatori della comunicazione embrione/feto-materna, anche attraverso le vescicole extracellulari (EV) derivate dalla placenta [86]. Le EV svolgono un ruolo particolarmente importante nella modulazione dell’immunità materna durante la gravidanza [87]. La secrezione di EV è un meccanismo attraverso il quale la placenta evita gli effetti citotossici del sistema immunitario materno per regolare la tolleranza immunitaria verso gli antigeni fetali. Il ligando di Fas (FASL) e il ligando induttore di apoptosi correlato al TNF (TRAIL) sono trasportati dalle EV secrete dal sinciziotrofoblasto e mediano l’apoptosi dei linfociti T, potenziando l’immunotolleranza. Inoltre, le EV placentari aumentano la produzione di interferone-gamma (IFNγ) dipendente dai linfociti T [88]. I monociti materni si legano e internalizzano le EV placentari [88-90], che possono indurre il rilascio di citochine legate all’immunità di “tipo 2”, come TNFα, MIP-1α, IL-1α, IL-1β, IL-6, IL-8, mentre le citochine coinvolte nell’immunità di “tipo 1” vengono soppresse e regolate [90]. Il profilo secretorio delle EV placentari è significativamente alterato in condizioni patologiche come l’ipertensione indotta dalla gravidanza e il diabete gestazionale. Il rilascio di EV placentari è anche aumentato nella preeclampsia, con le EV che inducono effetti più infiammatori, antiangiogenici e procoagulanti [91,92]. Nel complesso, sembra ora evidente che le EV placentari siano di rilevanza critica per il controllo della risposta immunitaria materna e possano contribuire all’induzione di gravi complicanze metaboliche e vascolari della gravidanza [91].
Le richieste materne di inositolo vengono in parte soddisfatte dalla dieta, in particolare da legumi e frutta, con l’assorbimento intestinale che avviene principalmente sotto forma di acido fitico, anche chiamato inositolo esafosfato (IP6) [93]. Una proporzione significativa di inositolo viene sintetizzata in modo endogenonel corpo umano. Il MI è di gran lunga l’isomero predominante dell’inositolo nei mammiferi e può essere prodotto a partire dal glucosio. In questa via, primariamente il glucosio-6-fosfato viene isomerizzato dall’inositolo-3-fosfato sintasi 1 (ISYNA1) per formare l’inositolo-3-fosfato (IP3). Poi l’IP3 viene de-fosforilato dall’inositolo monofosfatasi (IMPA1) e viene formato il MI. Questi due enzimi sono sottoposti all’effetto di feedback negativo del MI, affinchè venga mantenuta una certa omeostasi intracellulare. Un enzima epimerasi insulino-dipendente può quindi convertire il MI in DCI, mentre altri enzimi convertono ilMI in stereoisomeri minori, tra cui lo scyllo-inositolo [94,95]. Nel frattempo, la mio-inositolo ossigenasi (MIOX) degrada l’MI in D-glucoronato.
Negli adulti, i reni sono il sito predominante di sintesi del MI [96], ma quantità apprezzabili sono sintetizzate anche dal cervello e dalle gonadi, mentre la MIOX è altamente espressa nei reni e nei tessuti nervosi [97]. Il sistema nervoso centrale fetale, i polmoni, il fegato, i reni e la placenta esprimono anche in modo significativo questi enzimi e si ritiene che siano produttori attivi di MI durante lo sviluppo fetale [98-100].
Esistono tre diversi trasportatori attivi per l’uptake di MI nelle cellule: i trasportatori di sodio/inositolo 1 o 2 (SMIT1 o SMIT2) e i sistemi del trasportatore H (+)-MI 1 (HMIT 1) [101-103]. L’assorbimento di MI è inibito in modo competitivo dal glucosio e da altri zuccheri nelle cellule intestinali e nei tubuli renali. È interessante notare che l’assorbimento di MI dipendente dal sodio diminuisce nei tessuti nervosi in caso di iperglicemia. Al contrario, questo effetto non è stato dimostrato nel trasporto mediato da HMIT1. Tuttavia, altri isomeri dell’inositolo competono con il MI per l’assorbimento attraverso HMIT1 [104]. Nel feto del ratto, ci sono cambiamenti ontogenetici nell’espressione dei trasportatori all’interno dei tessuti, con un’alta espressione di SMIT nel sistema nervoso centrale durante le prime fasi della gestazione, seguita da una diminuzione con l’avanzare della gestazione, mentre l’espressione di SMIT nel rene aumenta significativamente dopo la nascita [105], forse riflettendo le diverse esigenze di inositolo durante le diverse fasi dello sviluppo di ciascun tessuto.
Studi precedenti, limitati dalle tecniche di quantificazione dell’inositolo, hanno riportato concentrazioni stabili di MI sierico materno durante la gestazione a un livello simile a quello delle donne non gravide, intorno a 21-26 mM [100]. Tuttavia, nuovi studi che utilizzano tecniche più sensibili di LCMS indicano un lieve calo dell’MI circolante man mano che la gestazione progredisce (dati non pubblicati). Nelle gravidanze non complicate, l’escrezione urinaria di IPG-P aumenta con l’avanzare della gestazione [106] ed è due volte superiore al terzo trimestre rispetto alla situazione di non gravidanza, raggiungendo un picco poco prima del parto [107]. Il livello urinario di IPG-P è più elevato durante il travaglio rispetto alle donne non in travaglio, suggerendo un ruolo nell’inizio o nel progresso del travaglio [108].
Le concentrazioni fetali di MI sono generalmente più elevate rispetto ai livelli materni corrispondenti, e le concentrazioni circolanti fetali diminuiscono con l’avanzare della gestazione. Le concentrazioni di MI nel liquido amniotico del secondo trimestre [109] e nel sangue del cordone ombelicale fetale a termine sono più elevate rispetto al sangue materno [33]. Inoltre, i titoli di MI nel sangue del cordone ombelicale a metà gestazione (125μM) [100] e nei neonati pretermine (108μM) sono significativamente più alti rispetto a quelli a termine (86μM) [110]. Inoltre, il P-IPG nel liquido amniotico diminuisce nel terzo trimestre rispetto alle fasi precedenti della gravidanza [106].
Tutte le evidenze indicano che l’unità fetale-placentare sia una maggiore produttrice di inositolo rispetto alla madre, piuttosto che il trasferimento preferenziale di inositolo dalla madre all’unità fetale-placentare. Alla nascita, si trovano concentrazioni di inositolo costantemente più elevate nel sangue dell’arteria ombelicale (75μM), che fluisce dal feto alla placenta, rispetto al sangue venoso ombelicale (64μM), che fluisce dalla placenta al feto [34], suggerendo un trasferimento fetale-placentare di inositolo. Inoltre, solo il 10% o meno dell’MI circolante fetale deriva dalla fornitura materna transplacentare in uno studio con inositolo marcatore isotopico condotto alla fine della gravidanza [111].
Nella placenta umana a termine, l’espressione di IMPA1 è fortemente correlata con il contenuto di inositolo placentare, con correlazioni più deboli osservate con SMIT2 e HMIT [112]. Questa correlazione suggerisce fortemente che gran parte dell’inositolo placentare sia sintetizzato localmente, con un ruolo meno rilevante dell’importazione dalle circolazioni materna o fetale. Insieme, sembra che il feto sia un esportatore netto di inositolo verso la placenta e che, possibilmente, l’unità fetale-placentare possa essere un esportatore di inositolo verso il compartimento materno, con una diminuzione dei livelli di inositolo fetale riflessa da una corrispondente diminuzione dei livelli circolanti materni all’avanzare della gestazione. Certamente, vi è un movimento di inositoli attraverso l’asse materno-placentare-fetale, ma ciò che rimane poco chiaro è se il trasferimento di inositolo e dei suoi derivati attraverso i tre compartimenti costituisca un importante segnale di comunicazione inviato dal feto per regolare la funzione placentare e l’adattamento materno, al fine di adattare l’apporto di nutrienti alle proprie esigenze di sviluppo.
Livelli più bassi di MI sono stati associati a dismorfogenesi fetale, maturazione dei tessuti interrotta e dimensioni fetali alterate. Durante lo sviluppo normale dei mammiferi, il sistema nervoso centrale fetale, i tessuti renali e muscolari contengono inositolo a livelli equivalenti alla parte superiore dei tessuti adulti corrispondenti, suggerendo ruoli particolarmente importanti nello sviluppo, mentre il fegato e il cuore fetali hanno in generale livelli inferiori rispetto agli adulti [36].
Livelli di MI circolante materno nel decile più basso sono stati associati a un aumento del rischio di spina bifida [113], e i risultati che il rischio non fosse associato ai livelli di inositolo nel liquido amniotico suggeriscono che la radice del problema potrebbe non essere nel feto [114]. Studi su topi curly tail sani hanno dimostrato che l’integrazione di DCI e MI riduceva la frequenza di spina bifida folato-resistente [115]. Nei modelli animali di difetti del tubo neurale indotti dal glucosio, si è riscontrata una riduzione del contenuto di inositolo nel neuroectoderma e il trattamento con prostaglandina E2 o MI ha potuto prevenire il difetto [116]. Poiché l’inibizione della sintesi di prostaglandine ha annullato l’effetto del MI, si suggerisce che questo effetto protettivo del MI sia mediato dalla sua promozione della sintesi di prostaglandine dall’acido arachidonico. Nel complesso, si potrebbe ipotizzare che l’integrazione di MI materna possa ridurre i difetti del tubo neurale, in particolare nei casi ad alto rischio come una precedente gravidanza complicata da un difetto del tubo neurale fetale o diabete materno pre-gravidanza, ma sono ancora necessari studi clinici per confermare questo.
La diminuzione fisiologica dell’inositolo circolante fetale sembra importante nel promuovere la maturazione polmonare verso la fine della gravidanza. Nei modelli animali, un livello più basso di inositolo influenza la produzione di surfattante polmonare fetale e altera l’equilibrio dei fosfolipidi verso un rapporto più elevato tra fosfatidilglicerolo e fosfatidilinositolo, promuovendo l’apertura degli alveoli e la ventilazione alla nascita [117].
Tuttavia, l’assunzione continua di inositolo era comunque considerata importante per ridurre il rischio di distress respiratorio e displasia broncopolmonare nei neonati pretermine molto prematuri che ricevevano alimentazione parenterale priva di inositolo [118]. Nonostante i risultati inizialmente promettenti dell’integrazione di MI, l’ultima revisione Cochrane, che ha incluso sei studi controllati randomizzati, ha concluso che l’integrazione di inositolo nei neonati pretermine non riduce il rischio di esiti avversi, tra cui mortalità infantile, retinopatia, emorragia intracranica, infezione, malattia gastrointestinale e malattia polmonare cronica [119].
Concentrazioni aumentate di MI urinario nei neonati sono state associate sia a neonati piccoli per l’età gestazionale (SGA) sia a neonati grandi per l’età gestazionale (LGA) [120,121], così come a suini con ritardo di crescita [122]. Pertanto, la disregolazione dell’inositolo potrebbe essere implicata in entrambe le estremità dei disturbi della crescita fetale, ma le vie meccanicistiche rimangono speculative. Nella crescita fisiologica normale, si ipotizza che la modulazione fetale della produzione endogena di inositolo possa essere utilizzata come meccanismo di segnalazione per adattare l’accesso nutrizionale dai compartimenti materni e placentari per sostenere la propria crescita [36]. Poiché il glucosio e i lipidi costituiscono i substrati dai quali il feto genera energia e massa grassa per la crescita, si potrebbe immaginare che la produzione endogena fetale-placentare di inositolo possa avvenire in risposta all’ambiente glicemico e lipidico in utero in modo tale che venga fornita la quantità corretta di nutrienti attraverso la placenta per soddisfare le richieste.
Dopotutto, ci sono prove che nel tessuto placentare il glucosio stesso, nell’intervallo fisiologico normale, potrebbe influenzare direttamente l’espressione dell’enzima IMPA1 che sintetizza MI [112], e lo stesso potrebbe avvenire nei tessuti fetali. Pertanto, l’inositolo potrebbe favorire la moderazione della crescita fetale e ridurre il rischio di dimensioni estreme. Nei casi di neonati LGA e SGA, tali meccanismi fisiologici mediati dall’inositolo potrebbero essere insufficienti o malfunzionanti, forse a causa di eccesso di glucosio o lipidi, disfunzione placentare o disregolazione del trasporto e del metabolismo dell’inositolo. Un aumento maggiore dell’inositolo urinario nei casi di crescita intrauterina disturbata potrebbe anche rappresentare parte di una risposta adattiva; un aumento esagerato della produzione di inositolo finalizzato al compensare la presenza di altre patologie che hanno influenzato la crescita; esempi includono l’insufficienza utero-placentare o l’iperglicemia [36].A sostegno di tali ipotesi, le osservazioni delle coorti madre-prole hanno riportato che gli aumenti del peso alla nascita indotti dal glucosio e dell’adiposità neonatale sono stati significativamente attenuati con livelli più elevati di inositolo placentare rispetto ai casi con inositolo placentare più basso [112,123]. Tale effetto attenuante dell’inositolo placentare è risultato ancora più marcato nelle gravidanze complicate da diabete gestazionale [123]. Alcuni trial clinici di integrazione materna di MI hanno riportato riduzioni del rischio di macrosomia fetale insieme a riduzioni del diabete gestazionale [9,124], mentre altri non hanno suggerito tali potenziali meccanismi sottostanti siano complessi e dipendenti dalla popolazione [11,45].
Un meccanismo attraverso il quale l’inositolo potrebbe influenzare la crescita fetale è la regolazione del metabolismo lipidico placentare, che determina il passaggio degli acidi grassi al feto. Studi in vitro su espianti placentari umani hanno riportato che gli effetti del MI sul processo lipidico placentare dipendevano dagli acidi grassi, aumentando l’incorporazione di acido oleico in vari lipidi ma riducendo l’incorporazione di acido docosaesaenoico (DHA) nei trigliceridi [75], determinando infine la quantità di acidi grassi trasferiti al feto. Inoltre, gli effetti dell’inositolo sul processo lipidico placentare erano influenzati dal BMI materno e dai livelli di glicemia gestazionale, riflettendo le complesse interazioni tra questi fattori. È plausibile che le caratteristiche metaboliche materne possano programmare le risposte placentari all’inositolo. Studi successivi hanno indicato che il trattamento con MI di espianti placentari agiva per moderare gli estremi del metabolismo del DHA placentare associati a entrambe le estremità dello spettro del BMI; l’inositolo agiva per portare i livelli lipidici di DHA verso una media fisiologica [125].
Questo è coerente con l’ipotesi che l’inositolo possa servire per adattare l’apporto di nutrienti al fine di moderare la crescita fetale e influenzare le dimensioni lontano dagli estremi. L’inositolo potrebbe anche influenzare la crescita fetale facilitando le vie di segnalazione PI3K dei fattori di crescita simili all’insulina, IGF-1 e IGF-2, nel feto e nella placenta [126]. IGF-1 e IGF-2 materni e fetali circolanti sono fortemente associati alla promozione del trasporto di nutrienti placentari (ad esempio, l’espressione di GLUT1 e il trasferimento di glucosio) e alle dimensioni fetali [127,128]. IGF-1 potrebbe anche ridurre l’assunzione di acidi grassi placentari inibendo l’attività della lipasi lipoproteica placentare [129].
Oltre alla placenta, il trattamento con MI potrebbe anche influire sui tessuti materni per influenzare la mobilizzazione di nutrienti per la crescita fetale. Sebbene un miglioramento della sensibilità insulinica materna che porta a una riduzione della glicemia potrebbe verificarsi con l’aumento dell’MI, la regolazione della lipidemia potrebbe rappresentare un percorso indipendente. In un modello murino di GDM con dieta ad alto contenuto di grassi, sebbene non ci sia stato alcun cambiamento nell’accumulo generale di grasso materno o nella glicemia, è stata osservata un’incrementata espressione di composti di segnalazione insulinica nel tessuto adiposo materno associata a una riduzione del peso alla nascita dei nascituri [30]. Inoltre, vari derivati dell’inositolo possono modulare le azioni degli ormoni e dei composti di segnalazione per alterare anche la disponibilità di nutrienti da trasferire al feto. Ad esempio, i fosfati di inositolo agiscono nei sinciziotrofoblasti placentari per indurre il rilascio di lattogeno placentare umano (hPL) nella circolazione materna. In questo modo, può alterare lo stato metabolico materno opponendosi all’azione dell’insulina nei tessuti materni per mobilizzare i nutrienti necessari al feto [130].
Gli inositoli fosfati sono coinvolti anche in molti altri importanti percorsi metabolici e di segnalazione placentare, come l’attivazione del fosfatidilinositolo (3,4,5)-trisfosfato (PIP3) della fosfolipasi D placentare, che porta all’idrolisi dei fosfolipidi, al rilascio di acido fosfatidico per modulare le attività di proteine chinasi e lipochinasi e fosfatasi e aumentare la produzione di altri segnali lipidici come DAG e LPA, insieme ad acidi grassi non esterificati per l’apporto fetale [131,132].La leptina è un altro ormone che può essere regolato dai derivati dell’inositolo. La leptina aumenta la glicemia materna, gli aminoacidi e i lipidi circolanti per l’apporto fetale, e una concentrazione maggiore di leptina materna è associata a un peso alla nascita più elevato [133]. L’inositolo fosfoglicano IPG-A può inibire il rilascio di leptina dagli adipociti di ratti non gravidi [107] e il trattamento con MI di topi obesi non gravidi con dieta ad alto contenuto di grassi ha ridotto i livelli plasmatici di leptina [134]. Se lo stesso avvenisse in gravidanza, IPG-A potrebbe potenzialmente moderare il peso alla nascita.
Il contenuto di inositolo placentare è ridotto nel GDM, ciò si ritiene essere dovuto principalmente alla diminuzione della sintesi placentare di inositolo causata dalla downregulation dell’enzima di sintesi, l’inositolo monofosfatasi (IMPA1) [112]. Nel frattempo, si riporta un aumento del contenuto di inositolo placentare nella preeclampsia [135]. Data la potenziale vasta gamma di effetti dell’inositolo e dei suoi derivati sulla funzione e la segnalazione placentare, un’elaborazione alterata dell’inositolo e squilibri nei derivati dell’inositolo avrebbero implicazioni per la crescita fetale. Ci sono vie placentari in cui l’inositolo può favorire l’apporto di nutrienti fetali (ad esempio, facilitando la segnalazione dell’IGF, aumentando il rilascio di hPL), mentre ci sono altre vie in cui l’inositolo può sopprimere l’apporto (ad esempio, la promozione di IPG-P nella sintesi del glicogeno placentare). Il trasporto e il metabolismo disfunzionali dell’inositolo placentare e la conseguente incapacità di regolare in modo ottimale l’apporto di nutrienti fetali potrebbero spiegare in parte la predominanza di macrosomia nel GDM e la limitazione della crescita nella preeclampsia. Uno studio clinico sull’uso di MI materna più alfa-lattoalbumina nel GDM ha mostrato promettenti risultati nella soppressione della crescita eccessiva del feto, insieme alla riduzione della resistenza insulinica materna [136]. Se gli effetti siano stati in qualche modo mediati dall’aumento del contenuto di inositolo placentare o da un miglioramento della comunicazione materno-placentare-fetale mediata dall’inositolo è un ambito che richiede ulteriori indagini.
Nonostante molto rimanga ancora da comprendere sul ruolo dell’inositolo e dei suoi derivati nel favorire e promuovere l’adattamento materno alla gravidanza, la funzione e la segnalazione placentare ottimali e la crescita sana e lo sviluppo del feto, tutte le evidenze indicano un ruolo cruciale dell’inositolo nel bilanciare e modulare eventi critici che si verificano durante la gravidanza. Al fine di sfruttare appieno il potenziale dell’integrazione di inositolo e delle terapie correlate nel trattamento delle complicanze della gravidanza, è necessario approfondire la comprensione dei meccanismi coinvolti. Basandoci sui concetti delle origini dello sviluppo della salute e delle malattie (DOHaD), se fosse possibile moderare la crescita e lo sviluppo fetale senza effetti avversi utilizzando un composto naturale facilmente accettabile come l’inositolo, potrebbe avere conseguenze a lungo termine e di ampia portata sulla salute delle future generazioni.
[1] Catalano PM. Obesity, insulin resistance, and pregnancy outcome. Reproduction 2010;140
(3):365–71. https://doi.org/10.1530/REP-10-0088.
[2] Coustan DR. Can a dietary supplement prevent gestational diabetes mellitus? Diabetes Care 2013;36
(4):777–9. https://doi.org/10.2337/dc12-2505.
[3] Croze ML, Soulage CO. Potential role and therapeutic interests of myo-inositol in metabolic diseases.
Biochimie 2013;95(10):1811–27. https://doi.org/10.1016/j.biochi.2013.05.011.
[4] Nestler JE, Unfer V. Reflections on inositol(s) for PCOS therapy: steps toward success. Gynecol
Endocrinol 2015;31(7):501–5. https://doi.org/10.3109/09513590.2015.1054802.
[5] Goel M, Azev VN, d’Alarcao M. The biological activity of structurally defined inositol glycans. Future
Med Chem 2009;1(1):95–118. https://doi.org/10.4155/fmc.09.6.
[6] Murphy A, Shamshirsaz A, Markovic D, Ostlund R, Koos B. Urinary excretion of myo-inositol and
D-chiro-inositol in early pregnancy is enhanced in gravidas with gestational diabetes mellitus. Reprod
Sci 2016;23(3):365–71. https://doi.org/10.1177/1933719115602767.
[7] Scioscia M, Gumaa K, Selvaggi LE, Rodeck CH, Rademacher TW. Increased inositol phosphoglycan
P-type in the second trimester in pregnant women with type 2 and gestational diabetes mellitus.
J Perinat Med 2009;37(5):469–71. https://doi.org/10.1515/JPM.2009.082.
[8] Scioscia M, Kunjara S, Gumaa K, Gomez Galan AM, McLean P, Rodeck CH, Rademacher TW.
Altered urinary release of inositol phosphoglycan A-type in women with gestational diabetes mellitus.
Gynecol Obstet Investig 2007;64(4):217–23. https://doi.org/10.1159/000106494.
[9] Santamaria A, Alibrandi A, Di Benedetto A, Pintaudi B, Corrado F, Facchinetti F, D’Anna R. Clinical
and metabolic outcomes in pregnant women at risk for gestational diabetes mellitus supplemented
with myo-inositol: a secondary analysis from 3 RCTs. Am J Obstet Gynecol 2018;219(3):300.
e1–6. https://doi.org/10.1016/j.ajog.2018.05.018.
[10] Farren M, Daly N, McKeating A, Kinsley B, Turner MJ, Daly S. The prevention of gestational diabetes
mellitus with antenatal oral inositol supplementation: a randomized controlled trial. Diabetes
Care 2017;40(6):759–63. https://doi.org/10.2337/dc16-2449.
[11] Godfrey KM, Barton SJ, El-Heis S, Kenealy T, Nield H, Baker PN, Chong YS, Cutfield W, Chan
SY, PPeR Study Group Ni. Myo-inositol, probiotics, and micronutrient supplementation from preconception
for glycemia in pregnancy: NiPPeR international multicenter double-blind randomized
controlled trial. Diabetes Care 2021. https://doi.org/10.2337/dc20-2515.
[12] Cheng MH, Wang PH. Placentation abnormalities in the pathophysiology of preeclampsia. Expert
Rev Mol Diagn 2009;9(1):37–49. https://doi.org/10.1586/14737159.9.1.37.
[13] Paine MA, Scioscia M, Williams PJ, Gumaa K, Rodeck CH, Rademacher TW. Urinary inositol
phosphoglycan P-type as a marker for prediction of preeclampsia and novel implications for the pathophysiology
of this disorder. Hypertens Pregnancy 2010;29(4):375–84. https://doi.org/
10.3109/10641950903242667.
[14] Williams PJ, Gumaa K, Scioscia M, Redman CW, Rademacher TW. Inositol phosphoglycan P-type
in preeclampsia: a novel marker? Hypertension 2007;49(1):84–9. https://doi.org/10.1161/01.
HYP.0000251301.12357.ba.
[15] Scioscia M, Williams PJ, Gumaa K, Fratelli N, Zorzi C, Rademacher TW. Inositol phosphoglycans
and preeclampsia: from bench to bedside. J Reprod Immunol 2011;89(2):173–7. https://doi.org/
10.1016/j.jri.2011.03.001.
[16] Kunjara S, Wang DY, Greenbaum AL, McLean P, Kurtz A, Rademacher TW. Inositol phosphoglycans
in diabetes and obesity: urinary levels of IPG A-type and IPG P-type, and relationship to pathophysiological
changes. Mol Genet Metab 1999;68(4):488–502. https://doi.org/10.1006/
mgme.1999.2936.
[17] Scioscia M, Gumaa K, Kunjara S, Paine MA, Selvaggi LE, Rodeck CH, Rademacher TW. Insulin
resistance in human preeclamptic placenta is mediated by serine phosphorylation of insulin receptor
substrate-1 and -2. J Clin Endocrinol Metab 2006;91(2):709–17. https://doi.org/10.1210/jc.2005-
1965.
[18] D’Oria R, Laviola L, Giorgino F, Unfer V, Bettocchi S, Scioscia M. PKB/Akt and MAPK/ERK
phosphorylation is highly induced by inositols: novel potential insights in endothelial dysfunction
in preeclampsia. Pregnancy Hypertens 2017;10:107–12. https://doi.org/10.1016/j.
preghy.2017.07.001.
[19] D’Oria R, Laviola L, Scioscia M, Fascilla F, Bettocchi S, Giorgino F. PKB/Akt phosphorylation in
human umbilical vein endothelial cells is highly induced by myo-inositol and D- chiro inositol: novel
potential insights in the pathogenesis of preeclampsia. Pregnancy Hypertens 2017;7:56. https://doi.
org/10.1016/j.preghy.2016.10.005.
[20] Afroze SH, Kalagiri RR, Reyes M, Zimmerman JD, Beeram MR, Drever N, Zawieja DC, Kuehl TJ,
Uddin MN. Apoptotic and stress signaling markers are augmented in preeclamptic placenta and
umbilical cord. BBA Clin 2016;6:25–30. https://doi.org/10.1016/j.bbacli.2016.05.003.
[21] Li HY, Chang SP, Yuan CC, Chao HT, Ng HT, Sung YJ. Induction of p38 mitogen-activated protein
kinase-mediated apoptosis is involved in outgrowth of trophoblast cells on endometrial epithelial
cells in a model of human trophoblast-endometrial interactions. Biol Reprod 2003;69(5):1515–24.
https://doi.org/10.1095/biolreprod.103.015669.
[22] Hashemi Tari S, Sohouli MH, Lari A, Fatahi S, Rahideh ST. The effect of inositol supplementation on
blood pressure: a systematic review and meta-analysis of randomized-controlled trials. Clin Nutr
ESPEN 2021;44:78–84. https://doi.org/10.1016/j.clnesp.2021.06.017.
[23] Beach DC, Flick PK. Early effect of myo-inositol deficiency on fatty acid synthetic enzymes of rat
liver. Biochim Biophys Acta 1982;711(3):452–9. https://doi.org/10.1016/0005-2760(82)90059-5.
[24] Hayashi E, Hasegawa R, Tomita T. Accumulation of neutral lipids in Saccharomyces carlsbergensis by
myo-inositol deficiency and its mechanism. Reciprocal regulation of yeast acetyl-CoA carboxylase by
fructose bisphosphate and citrate. J Biol Chem 1976;251(18):5759–69. https://doi.org/10.1016/
S0021-9258(17)33121-6.
[25] Kim JN, Han SN, Kim HK. Phytic acid and myo-inositol support adipocyte differentiation and
improve insulin sensitivity in 3T3-L1 cells. Nutr Res 2014;34(8):723–31. https://doi.org/
10.1016/j.nutres.2014.07.015.
[26] Tabrizi R, Ostadmohammadi V, Lankarani KB, Peymani P, Akbari M, Kolahdooz F, Asemi Z. The
effects of inositol supplementation on lipid profiles among patients with metabolic diseases: a systematic
review and meta-analysis of randomized controlled trials. Lipids Health Dis 2018;17(1):123.
https://doi.org/10.1186/s12944-018-0779-4.
[27] Hayashi E, Maeda T, Hasegawa R, Tomita T. The effect of myo-inositol deficiency on lipid metabolism
in rats. III. The mechanism of an enhancement in lipolysis due to myo-inositol deficiency in rats.
Biochim Biophys Acta 1978;531(2):197–205. https://doi.org/10.1016/0005-2760(78)90143-1.
[28] Burton LE, Wells WW. Characterization of the lactation-dependent fatty liver in myo-inositol deficient
rats. J Nutr 1977;107(10):1871–83. https://doi.org/10.1093/jn/107.10.1871.
[29] Plows JF, Budin F, Andersson RA, Mills VJ, Mace K, Davidge ST, Vickers MH, Baker PN, Silva-
Zolezzi I, Stanley JL. The effects of myo-inositol and B and D vitamin supplementation in the db/+
mouse model of gestational diabetes mellitus. Nutrients 2017;9(2). https://doi.org/10.3390/
nu9020141.
[30] Plows JF, Ramos Nieves JM, Budin F, Mace K, Reynolds CM, Vickers MH, Silva-Zolezzi I, Baker
PN, Stanley JL. The effects of myo-inositol and probiotic supplementation in a high-fat-fed preclinical
model of glucose intolerance in pregnancy. Br J Nutr 2020;123(5):516–28. https://doi.org/10.1017/
S0007114519003039.
[31] de Waal E, Vrooman LA, Fischer E, Ord T, Mainigi MA, Coutifaris C, Schultz RM, Bartolomei MS.
The cumulative effect of assisted reproduction procedures on placental development and epigenetic perturbations in a mouse model. Hum Mol Genet 2015;24(24):6975–85. https://doi.org/10.1093/
hmg/ddv400.
[32] Cassidy FC, Charalambous M. Genomic imprinting, growth and maternal-fetal interactions. J Exp
Biol 2018;221(Pt Suppl 1). https://doi.org/10.1242/jeb.164517.
[33] Brusati V, Jozwik M, Jozwik M, Teng C, Paolini C, Marconi AM, Battaglia FC. Fetal and maternal
non-glucose carbohydrates and polyols concentrations in normal human pregnancies at term. Pediatr
Res 2005;58(4):700–4. https://doi.org/10.1203/01.PDR.0000180549.86614.73.
[34] Campling JD, Nixon DA. The inositol content of foetal blood and foetal fluids. J Physiol 1954;126
(1):71–80. https://doi.org/10.1113/jphysiol.1954.sp005192.
[35] Toh N, Inoue T, Tanaka H, Kimoto E. Polyol accumulation in human placenta and umbilical cord.
Biol Res Pregnancy Perinatol 1987;8(1):13–5.
[36] Watkins OC, Yong HEJ, Sharma N, Chan SY. A review of the role of inositols in conditions of insulin
dysregulation and in uncomplicated and pathological pregnancy. Crit Rev Food Sci Nutr 2020;1–49.
https://doi.org/10.1080/10408398.2020.1845604.
[37] Nair S, Salomon C. Extracellular vesicles and their immunomodulatory functions in pregnancy.
Semin Immunopathol 2018;40(5):425–37. https://doi.org/10.1007/s00281-018-0680-2.
[38] Blackburn ST. Maternal, fetal, & neonatal physiology: a clinical perspective. St. Louis, MO: Saunders
Elsevier; 2007.
[39] Dilworth MR, Sibley CP. Review: transport across the placenta of mice and women. Placenta
2013;34(Suppl):S34–9. https://doi.org/10.1016/j.placenta.2012.10.011.
[40] Rossant J, Cross JC. Placental development: lessons from mouse mutants. Nat Rev Genet 2001;2
(7):538–48. https://doi.org/10.1038/35080570.
[41] Silva JF, Serakides R. Intrauterine trophoblast migration: a comparative view of humans and rodents.
Cell Adhes Migr 2016;10(1-2):88–110. https://doi.org/10.1080/19336918.2015.1120397.
[42] Russo M, Forte G, Montanino Oliva M, Lagana AS, Unfer V. Melatonin and myo-inositol: supporting
reproduction from the oocyte to birth. Int J Mol Sci 2021;22(16). https://doi.org/10.3390/
ijms22168433.
[43] Kuscu N, Bizzarri M, Bevilacqua A. Myo-inositol safety in pregnancy: from preimplantation development
to newborn animals. Int J Endocrinol 2016;2016, 2413857. https://doi.org/10.1155/2016/
2413857.
[44] Nazari L, Salehpour S, Hosseini S, Saharkhiz N, Azizi E, Hashemi T, Ghodssi-Ghassemabadi R.
Effect of myo-inositol supplementation on ICSI outcomes among poor ovarian responder patients:
a randomized controlled trial. J Gynecol Obstet Hum Reprod 2020;49(5), 101698. https://doi.
org/10.1016/j.jogoh.2020.101698.
[45] Fowden AL, Forhead AJ. Hormones as epigenetic signals in developmental programming. Exp Physiol
2009;94(6):607–25. https://doi.org/10.1113/expphysiol.2008.046359.
[46] Fowden AL, Sibley C, Reik W, Constancia M. Imprinted genes, placental development and fetal
growth. Horm Res 2006;65(Suppl 3):50–8. https://doi.org/10.1159/000091506.
[47] Jansson T, Powell TL. Role of the placenta in fetal programming: underlying mechanisms and potential
interventional approaches. Clin Sci (Lond) 2007;113(1):1–13. https://doi.org/10.1042/
CS20060339.
[48] Myatt L. Placental adaptive responses and fetal programming. J Physiol 2006;572(Pt 1):25–30. https://
doi.org/10.1113/jphysiol.2006.104968.
[49] Lager S, Powell TL. Regulation of nutrient transport across the placenta. J Pregnancy 2012;2012,
179827. https://doi.org/10.1155/2012/179827.
[50] Uchida K, Nakazawa M, Yamagishi C, Mikoshiba K, Yamagishi H. Type 1 and 3 inositol trisphosphate
receptors are required for extra-embryonic vascular development. Dev Biol 2016;418
(1):89–97. https://doi.org/10.1016/j.ydbio.2016.08.007.
[51] Yang F, Huang L, Tso A, Wang H, Cui L, Lin L, Wang X, Ren M, Fang X, Liu J, Han Z, Chen J,
Ouyang K. Inositol 1,4,5-trisphosphate receptors are essential for fetal-maternal connection and
embryo viability. PLoS Genet 2020;16(4), e1008739. https://doi.org/10.1371/journal.pgen.
1008739.
[52] Kryvenko V, Wessendorf M, Tello K, Herold S, Morty RE, Seeger W, Vadasz I. Hypercapnia induces
inositol-requiring enzyme 1alpha-driven endoplasmic reticulum-associated degradation of the Na,KRole ATPase beta-subunit. Am J Respir Cell Mol Biol 2021;65(6):615–29. https://doi.org/10.1165/
rcmb.2021-0114OC.
[53] Cook ZC, Gray MA, Cann MJ. Elevated carbon dioxide blunts mammalian cAMP signaling dependent
on inositol 1,4,5-triphosphate receptor-mediated Ca2+ release. J Biol Chem 2012;287
(31):26291–301. https://doi.org/10.1074/jbc.M112.349191.
[54] Gersonde K, Nicolau C. Improvement of the red blood cell O2 release capacity by lipid vesiclemediated
incorporation of inositol hexaphosphate. Blutalkohol 1979;39(1):1–7. https://doi.org/
10.1007/BF01008069.
[55] Coan PM, Vaughan OR, Sekita Y, Finn SL, Burton GJ, Constancia M, Fowden AL. Adaptations in
placental phenotype support fetal growth during undernutrition of pregnant mice. J Physiol 2010;588
(Pt 3):527–38. https://doi.org/10.1113/jphysiol.2009.181214.
[56] Hempstock J, Cindrova-Davies T, Jauniaux E, Burton GJ. Endometrial glands as a source of nutrients,
growth factors and cytokines during the first trimester of human pregnancy: a morphological and
immunohistochemical study. Reprod Biol Endocrinol 2004;2:58. https://doi.org/10.1186/1477-
7827-2-58.
[57] Burton GJ, Fowden AL. The placenta: a multifaceted, transient organ. Philos Trans R Soc Lond Ser
B Biol Sci 2015;370(1663):20140066. https://doi.org/10.1098/rstb.2014.0066.
[58] Atkinson DE, Boyd RDH, Sibley CP. Chapter 52. Placental transfer. In: Neill JD, editor. Knobil and
Neill’s physiology of reproduction. 3rd ed. St Louis: Academic Press; 2006. p. 2787–846.
[59] Brett KE, Ferraro ZM, Yockell-Lelievre J, Gruslin A, Adamo KB. Maternal-fetal nutrient transport in
pregnancy pathologies: the role of the placenta. Int J Mol Sci 2014;15(9):16153–85. https://doi.org/
10.3390/ijms150916153.
[60] Hay Jr WW. Placental-fetal glucose exchange and fetal glucose metabolism. Trans Am Clin Climatol
Assoc 2006;117:321–40.
[61] Zhou J, Bondy CA. Placental glucose transporter gene expression and metabolism in the rat. J Clin
Invest 1993;91(3):845–52. https://doi.org/10.1172/jci116305.
[62] Deborde S, Schofield JN, Rademacher TW. Placental GPI-PLD is of maternal origin and its GPI
substrate is absent from placentae of pregnancies associated with pre-eclampsia. J Reprod Immunol
2003;59(2):277–94. https://doi.org/10.1016/s0165-0378(03)00054-8.
[63] Varela-Nieto I, Leon Y, Caro HN. Cell signalling by inositol phosphoglycans from different species.
Comp Biochem Physiol B Biochem Mol Biol 1996;115(2):223–41. https://doi.org/10.1016/0305-
0491(96)00087-9.
[64] Ayuk PT, Sibley CP, Donnai P, D’Souza S, Glazier JD. Development and polarization of cationic
amino acid transporters and regulators in the human placenta. Am J Phys Cell Physiol 2000;278
(6):C1162–71. https://doi.org/10.1152/ajpcell.2000.278.6.C1162.
[65] Cleal JK, Lewis RM. The mechanisms and regulation of placental amino acid transport to the human
foetus. J Neuroendocrinol 2008;20(4):419–26. https://doi.org/10.1111/j.1365-2826.2008.01662.x.
[66] Desforges M, Lacey HA, Glazier JD, Greenwood SL, Mynett KJ, Speake PF, Sibley CP. SNAT4 isoform
of system A amino acid transporter is expressed in human placenta. Am J Phys Cell Physiol
2006;290(1):C305–12. https://doi.org/10.1152/ajpcell.00258.2005.
[67] Desforges M, Mynett KJ, Jones RL, Greenwood SL, Westwood M, Sibley CP, Glazier JD. The
SNAT4 isoform of the system A amino acid transporter is functional in human placental microvillous
plasma membrane. J Physiol 2009;587(1):61–72. https://doi.org/10.1113/jphysiol.2008.161331.
[68] Lembach K, Charalampous FC. Metabolic functions of myo-inositol. VI. Impairment of amino acid
transport in KB cells caused by inositol deficiency. J Biol Chem 1967;242(11):2606–14.
[69] Wullschleger S, Loewith R, Hall MN. TOR signaling in growth and metabolism. Cell 2006;124
(3):471–84. https://doi.org/10.1016/j.cell.2006.01.016.
[70] Jansson T, Aye IL, Goberdhan DC. The emerging role of mTORC1 signaling in placental nutrientsensing.
Placenta 2012;33(Suppl 2):e23–9. https://doi.org/10.1016/j.placenta.2012.05.010.
[71] Roos S, Jansson N, Palmberg I, Saljo K, Powell TL, Jansson T. Mammalian target of rapamycin in the
human placenta regulates leucine transport and is down-regulated in restricted fetal growth. J Physiol
2007;582(Pt 1):449–59. https://doi.org/10.1113/jphysiol.2007.129676.
[72] Duttaroy AK. Transport of fatty acids across the human placenta: a review. Prog Lipid Res 2009;48
(1):52–61. https://doi.org/10.1016/j.plipres.2008.11.001.
[73] Haggarty P. Fatty acid supply to the human fetus. Annu Rev Nutr 2010;30:237–55. https://doi.org/
10.1146/annurev.nutr.012809.104742.
[74] Perazzolo S, Hirschmugl B, Wadsack C, Desoye G, Lewis RM, Sengers BG. The influence of placental
metabolism on fatty acid transfer to the fetus. J Lipid Res 2017;58(2):443–54. https://doi.org/
10.1194/jlr.P072355.
[75] Watkins OC, Islam MO, Selvam P, Pillai RA, Cazenave-Gassiot A, Bendt AK, Karnani N, Godfrey
KM, Lewis RM, Wenk MR, Chan SY. Myo-inositol alters 13C-labeled fatty acid metabolism in
human placental explants. J Endocrinol 2019. https://doi.org/10.1530/JOE-19-0267.
[76] Kiani AK, Paolacci S, Calogero AE, Cannarella R, Di Renzo GC, Gerli S, Della Morte C, Busetto
GM, De Berardinis E, Del Giudice F, Stuppia L, Facchinetti F, Dinicola S, Bertelli M. From Myoinositol
to D-chiro-inositol molecular pathways. Eur Rev Med Pharmacol Sci 2021;25(5):2390–402.
https://doi.org/10.26355/eurrev_202103_25279.
[77] Belkacemi L, Bedard I, Simoneau L, Lafond J. Calcium channels, transporters and exchangers in placenta:
a review. Cell Calcium 2005;37(1):1–8. https://doi.org/10.1016/j.ceca.2004.06.010.
[78] Irvine RF, Moor RM, Pollock WK, Smith PM, Wreggett KA. Inositol phosphates: proliferation,
metabolism and function. Philos Trans R Soc Lond Ser B Biol Sci 1988;320(1199):281–98.
https://doi.org/10.1098/rstb.1988.0077.
[79] Volpe P, Krause KH, Hashimoto S, Zorzato F, Pozzan T, Meldolesi J, Lew DP. “Calciosome,” a
cytoplasmic organelle: the inositol 1,4,5-trisphosphate-sensitive Ca2+ store of nonmuscle cells? Proc
Natl Acad Sci U S A 1988;85(4):1091–5. https://doi.org/10.1073/pnas.85.4.1091.
[80] Berridge MJ. The inositol trisphosphate/calcium signaling pathway in health and disease. Physiol Rev
2016;96(4):1261–96. https://doi.org/10.1152/physrev.00006.2016.
[81] Choe CU, Ehrlich BE. The inositol 1,4,5-trisphosphate receptor (IP3R) and its regulators: sometimes
good and sometimes bad teamwork. Sci STKE 2006;2006(363):re15. https://doi.org/10.1126/
stke.3632006re15.
[82] Hirota J, Baba M, Matsumoto M, Furuichi T, Takatsu K, Mikoshiba K. T-cell-receptor signalling in
inositol 1,4,5-trisphosphate receptor (IP3R) type-1-deficient mice: is IP3R type 1 essential for T-cellreceptor
signalling? Biochem J 1998;333(Pt 3):615–9. https://doi.org/10.1042/bj3330615.
[83] Jee SH, Chiu HC, Tsai TF, Tsai WL, Liao YH, Chu CY, Kuo ML. The phosphotidyl inositol
3-kinase/Akt signal pathway is involved in interleukin-6-mediated Mcl-1 upregulation and antiapoptosis
activity in basal cell carcinoma cells. J Invest Dermatol 2002;119(5):1121–7. https://doi.
org/10.1046/j.1523-1747.2002.19503.x.
[84] Morrison BH, Bauer JA, Lupica JA, Tang Z, Schmidt H, DiDonato JA, Lindner DJ. Effect of inositol
hexakisphosphate kinase 2 on transforming growth factor beta-activated kinase 1 and NF-kappaB activation.
J Biol Chem 2007;282(21):15349–56. https://doi.org/10.1074/jbc.M700156200.
[85] Steinmann C, Landsverk ML, Barral JM, Boehning D. Requirement of inositol 1,4,5-trisphosphate
receptors for tumor-mediated lymphocyte apoptosis. J Biol Chem 2008;283(20):13506–9. https://
doi.org/10.1074/jbc.C800029200.
[86] Mor G, Cardenas I. The immune system in pregnancy: a unique complexity. Am J Reprod Immunol
2010;63(6):425–33. https://doi.org/10.1111/j.1600-0897.2010.00836.x.
[87] Germain SJ, Sacks GP, Sooranna SR, Sargent IL, Redman CW. Systemic inflammatory priming in
normal pregnancy and preeclampsia: the role of circulating syncytiotrophoblast microparticles.
J Immunol 2007;178(9):5949–56. https://doi.org/10.4049/jimmunol.178.9.5949.
[88] Southcombe J, Tannetta D, Redman C, Sargent I. The immunomodulatory role of syncytiotrophoblast
microvesicles. PLoS One 2011;6(5), e20245. https://doi.org/10.1371/journal.pone.0020245.
[89] Cronqvist T, Tannetta D, Morgelin M, Belting M, Sargent I, Familari M, Hansson SR. Syncytiotrophoblast
derived extracellular vesicles transfer functional placental miRNAs to primary human endothelial
cells. Sci Rep 2017;7(1):4558. https://doi.org/10.1038/s41598-017-04468-0.
[90] Messerli M, May K, Hansson SR, Schneider H, Holzgreve W, Hahn S, Rusterholz C. Feto-maternal
interactions in pregnancies: placental microparticles activate peripheral blood monocytes. Placenta
2010;31(2):106–12. https://doi.org/10.1016/j.placenta.2009.11.011.
[91] Hausvater A, Giannone T, Sandoval YH, Doonan RJ, Antonopoulos CN, Matsoukis IL, Petridou
ET, Daskalopoulou SS. The association between preeclampsia and arterial stiffness. J Hypertens
2012;30(1):17–33. https://doi.org/10.1097/HJH.0b013e32834e4b0f.
[92] Simeone P, Bologna G, Lanuti P, Pierdomenico L, Guagnano MT, Pieragostino D, Del Boccio P,
Vergara D, Marchisio M, Miscia S, Mariani-Costantini R. Extracellular vesicles as signaling mediators
and disease biomarkers across biological barriers. Int J Mol Sci 2020;21(7). https://doi.org/10.3390/
ijms21072514.
[93] Clements Jr RS, Darnell B. Myo-inositol content of common foods: development of a high-myoinositol
diet. Am J Clin Nutr 1980;33(9):1954–67. https://doi.org/10.1093/ajcn/33.9.1954.
[94] Ju S, Shaltiel G, Shamir A, Agam G, Greenberg ML. Human 1-D-myo-inositol-3-phosphate synthase
is functional in yeast. J Biol Chem 2004;279(21):21759–65. https://doi.org/10.1074/jbc.
M312078200.
[95] Larner J. D-chiro-inositol—its functional role in insulin action and its deficit in insulin resistance. Int
J Exp Diabetes Res 2002;3(1):47–60. https://doi.org/10.1080/15604280212528.
[96] Clements Jr RS, Diethelm AG. The metabolism of myo-inositol by the human kidney. J Lab Clin
Med 1979;93(2):210–9.
[97] Stewart MA, Sherman WR, Harris JT. Effects of galactose on levels of free myo-inositol in rat tissues.
Ann N Y Acad Sci 1969;165(2):609–14.
[98] Fagerberg L, Hallstrom BM, Oksvold P, Kampf C, Djureinovic D, Odeberg J, Habuka M, Tahmasebpoor
S, Danielsson A, Edlund K, Asplund A, Sjostedt E, Lundberg E, Szigyarto CA, Skogs M,
Takanen JO, Berling H, Tegel H, Mulder J, Nilsson P, Schwenk JM, Lindskog C, Danielsson F, Mardinoglu
A, Sivertsson A, von Feilitzen K, Forsberg M, Zwahlen M, Olsson I, Navani S, Huss M, Nielsen
J, Ponten F, Uhlen M. Analysis of the human tissue-specific expression by genome-wide
integration of transcriptomics and antibody-based proteomics. Mol Cell Proteomics 2014;13
(2):397–406. https://doi.org/10.1074/mcp.M113.035600.
[99] Guan G, Dai P, Shechter I. cDNA cloning and gene expression analysis of human myo-inositol
1-phosphate synthase. Arch Biochem Biophys 2003;417(2):251–9. https://doi.org/10.1016/s0003-
9861(03)00388-6.
[100] Quirk Jr JG, Bleasdale JE. myo-Inositol homeostasis in the human fetus. Obstet Gynecol 1983;62
(1):41–4.
[101] Coady MJ, Wallendorff B, Gagnon DG, Lapointe JY. Identification of a novel Na+/myo-inositol
cotransporter. J Biol Chem 2002;277(38):35219–24. https://doi.org/10.1074/jbc.M204321200.
[102] Kwon HM, Yamauchi A, Uchida S, Preston AS, Garcia-Perez A, Burg MB, Handler JS. Cloning of
the cDNa for aNa+/myo-inositol cotransporter, a hypertonicity stress protein. J Biol Chem 1992;267
(9):6297–301.
[103] Uldry M, Ibberson M, Horisberger JD, Chatton JY, Riederer BM, Thorens B. Identification of a
mammalian H(+)-myo-inositol symporter expressed predominantly in the brain. EMBO J 2001;20
(16):4467–77. https://doi.org/10.1093/emboj/20.16.4467.
[104] Greene DA, Lattimer SA. Sodium- and energy-dependent uptake of myo-inositol by rabbit peripheral
nerve. Competitive inhibition by glucose and lack of an insulin effect. J Clin Invest 1982;70
(5):1009–18. https://doi.org/10.1172/jci110688.
[105] Guo W, Shimada S, Tajiri H, Yamauchi A, Yamashita T, Okada S, Tohyama M. Developmental regulation
of Na+/myo-inositol cotransporter gene expression. Brain Res Mol Brain Res 1997;51(1-
2):91–6. https://doi.org/10.1016/s0169-328x(97)00220-9.
[106] Scioscia M, Kunjara S, Gumaa K, McLean P, Rodeck CH, Rademacher TW. Urinary excretion of
inositol phosphoglycan P-type in gestational diabetes mellitus. Diabet Med 2007;24(11):1300–4.
https://doi.org/10.1111/j.1464-5491.2007.02267.x.
[107] Kunjara S, Greenbaum AL, Wang DY, Caro HN, McLean P, Redman CW, Rademacher TW. Inositol
phosphoglycans and signal transduction systems in pregnancy in preeclampsia and diabetes: evidence
for a significant regulatory role in preeclampsia at placental and systemic levels. Mol Genet
Metab 2000;69(2):144–58. https://doi.org/10.1006/mgme.2000.2964.
[108] Paine MA, Rodeck CH, Williams PJ, Rademacher TW. Possible involvement of inositol
phosphoglycan-P in human parturition. J Reprod Immunol 2003;59(2):267–75. https://doi.org/
10.1016/s0165-0378(03)00053-6. [109] Santamaria A, Corrado F, Baviera G, Carlomagno G, Unfer V, D’Anna R. Second trimester amniotic
fluid myo-inositol concentrations in women later developing gestational diabetes mellitus or
pregnancy-induced hypertension. J Matern Fetal Neonatal Med 2016;29(14):2245–7. https://doi.
org/10.3109/14767058.2015.1081886.
[110] Pereira GR, Baker L, Egler J, Corcoran L, Chiavacci R. Serum myoinositol concentrations in premature
infants fed human milk, formula for infants, and parenteral nutrition. Am J Clin Nutr 1990;51
(4):589–93. https://doi.org/10.1093/ajcn/51.4.589.
[111] Staat BC, Galan HL, Harwood JE, Lee G, Marconi AM, Paolini CL, Cheung A, Battaglia FC. Transplacental
supply of mannose and inositol in uncomplicated pregnancies using stable isotopes. J Clin
Endocrinol Metab 2012;97(7):2497–502. https://doi.org/10.1210/jc.2011-1800.
[112] Pillai RA, Islam MO, Selvam P, Sharma N, Chu AHY, Watkins OC, Godfrey KM, Lewis RM, Chan
SY. Placental inositol reduced in gestational diabetes as glucose alters inositol transporters and IMPA1
enzyme expression. J Clin Endocrinol Metab 2021;106(2):e875–90. https://doi.org/10.1210/
clinem/dgaa814.
[113] Groenen PM, Peer PG, Wevers RA, Swinkels DW, Franke B, Mariman EC, Steegers-Theunissen
RP. Maternal myo-inositol, glucose, and zinc status is associated with the risk of offspring with spina
bifida. AmJ Obstet Gynecol 2003;189(6):1713–9. https://doi.org/10.1016/s0002-9378(03)00807-x.
[114] Groenen PM, Wevers RA, Janssen FS, Tuerlings JH, Merkus JM, Steegers-Theunissen RP. Are myoinositol,
glucose and zinc concentrations in amniotic fluid of fetuses with spina bifida different from
controls? Early Hum Dev 2003;71(1):1–8. https://doi.org/10.1016/s0378-3782(02)00040-3.
[115] Cogram P, Tesh S, Tesh J, Wade A, Allan G, Greene ND, Copp AJ. D-chiro-inositol is more effective
than myo-inositol in preventing folate-resistant mouse neural tube defects. Hum Reprod 2002;17
(9):2451–8. https://doi.org/10.1093/humrep/17.9.2451.
[116] Baker L, Piddington R, Goldman A, Egler J, Moehring J. Myo-inositol and prostaglandins reverse the
glucose inhibition of neural tube fusion in cultured mouse embryos. Diabetologia 1990;33(10):593–6.
https://doi.org/10.1007/BF00400202.
[117] Bourbon JR, Doucet E, Rieutort M, Pignol B, Tordet C. Role of myo-inositol in impairment of fetal
lung phosphatidylglycerol biosynthesis in the diabetic pregnancy: physiological consequences of a
phosphatidylglycerol-deficient surfactant in the newborn rat. Exp Lung Res 1986;11(3):195–207.
https://doi.org/10.3109/01902148609064296.
[118] Hallman M, Bry K, Hoppu K, Lappi M, Pohjavuori M. Inositol supplementation in premature infants
with respiratory distress syndrome. N Engl J Med 1992;326(19):1233–9. https://doi.org/10.1056/
NEJM199205073261901.
[119] Howlett A, Ohlsson A, Plakkal N. Inositol in preterm infants at risk for or having respiratory distress
syndrome. Cochrane Database Syst Rev 2019;7, CD000366. https://doi.org/10.1002/14651858.
CD000366.pub4.
[120] Barberini L, Noto A, Fattuoni C, Grapov D, Casanova A, Fenu G, Gaviano M, Carboni R, Ottonello
G, Crisafulli M, Fanos V, Dessi A. Urinary metabolomics (GC-MS) reveals that low and high birth
weight infants share elevated inositol concentrations at birth. J Matern Fetal Neonatal Med 2014;27
(Suppl 2):20–6. https://doi.org/10.3109/14767058.2014.954786.
[121] Marincola FC, Dessi A, Pattumelli MG, Corbu S, Ossicini C, Ciccarelli S, Agostino R, Mussap M,
Fanos V. (1)H NMR-based urine metabolic profile of IUGR, LGA, and AGA newborns in the first
week of life. Clin Chim Acta 2015;451(Pt A):28–34. https://doi.org/10.1016/j.cca.2015.08.008.
[122] Nissen PM, Oksbjerg N. Birth weight and postnatal dietary protein level affect performance, muscle
metabolism and meat quality in pigs. Animal 2011;5(9):1382–9. https://doi.org/10.1017/
S1751731111000401.
[123] Chu AHY, Tint MT, Chang HF, Wong G, Yuan WL, Tull D, Nijagal B, Narayana VK, Meikle PJ,
Chang KTE, Lewis RM, Chi C, Yap FKP, Tan KH, Shek LP, Chong YS, Gluckman PD, Lee YS,
Fortier MV, Godfrey KM, Eriksson JG, Karnani N, Chan SY. High placental inositol content associated
with suppressed pro-adipogenic effects of maternal glycaemia in offspring: the GUSTO cohort.
Int J Obes 2021;45(1):247–57. https://doi.org/10.1038/s41366-020-0596-5.
[124] Matarrelli B, Vitacolonna E, D’Angelo M, Pavone G, Mattei PA, Liberati M, Celentano C. Effect of
dietary myo-inositol supplementation in pregnancy on the incidence of maternal gestational diabetes mellitus and fetal outcomes: a randomized controlled trial. J Matern Fetal Neonatal Med 2013;26
(10):967–72. https://doi.org/10.3109/14767058.2013.766691. [125] Watkins OC, Selvam P, Pillai RA, et al. Myo-inositol moderates maternal BMI and glycemia related
variations in in-vitro placental 13C-DHA-metabolism, altering their relationships with birthweight.
Sci Rep 2022;12:14895. https://doi.org/10.1038/s41598-022-18309-2.
[126] Siddle K. Signalling by insulin and IGF receptors: supporting acts and new players. J Mol Endocrinol
2011;47(1):R1–10. https://doi.org/10.1530/JME-11-0022.
[127] Baumann MU, Schneider H, Malek A, Palta V, Surbek DV, Sager R, Zamudio S, Illsley NP. Regulation
of human trophoblast GLUT1 glucose transporter by insulin-like growth factor I (IGF-I).
PLoS One 2014;9(8), e106037. https://doi.org/10.1371/journal.pone.0106037.
[128] Jansson N, Rosario FJ, Gaccioli F, Lager S, Jones HN, Roos S, Jansson T, Powell TL. Activation of
placental mTOR signaling and amino acid transporters in obese women giving birth to large babies.
J Clin Endocrinol Metab 2013;98(1):105–13. https://doi.org/10.1210/jc.2012-2667.
[129] Magnusson-Olsson AL, Hamark B, Ericsson A, Wennergren M, Jansson T, Powell TL. Gestational
and hormonal regulation of human placental lipoprotein lipase. J Lipid Res 2006;47(11):2551–61.
https://doi.org/10.1194/jlr.M600098-JLR200.
[130] Zeitler P, Wu YQ, Handwerger S. Melittin stimulates phosphoinositide hydrolysis and placental lactogen
release: arachidonic acid as a link between phospholipase A2 and phospholipase C signaltransduction
pathways. Life Sci 1991;48(21):2089–95. https://doi.org/10.1016/0024-3205(91)
90166-9.
[131] Vinggaard AM, Hansen HS. Characterization and partial purification of phospholipase D from human
placenta. Biochim Biophys Acta 1995;1258(2):169–76. https://doi.org/10.1016/0005-2760(95)
00121-r.
[132] Wang X, Devaiah SP, Zhang W, Welti R. Signaling functions of phosphatidic acid. Prog Lipid Res
2006;45(3):250–78. https://doi.org/10.1016/j.plipres.2006.01.005.
[133] Tessier DR, Ferraro ZM, Gruslin A. Role of leptin in pregnancy: consequences of maternal obesity.
Placenta 2013;34(3):205–11. https://doi.org/10.1016/j.placenta.2012.11.035.
[134] Croze ML, Geloen A, Soulage CO. Abnormalities in myo-inositol metabolism associated with type 2
diabetes in mice fed a high-fat diet: benefits of a dietary myo-inositol supplementation. Br J Nutr
2015;113(12):1862–75. https://doi.org/10.1017/S000711451500121X.
[135] Lee GT, Price MD, Mejia CA, Galan HL, Arroyo JA. Increased trophoblast expression of NFAT5/
TonEBP in pre-eclamptic placentas and hyperosmolar-treated BeWo cells. Eur J Obstet Gynecol
Reprod Biol 2014;183:37–43. https://doi.org/10.1016/j.ejogrb.2014.10.002.
[136] D’Anna R, Corrado F, Loddo S, Gullo G, Giunta L, Di Benedetto A. Myoinositol plus alphalactalbumin
supplementation, insulin resistance and birth outcomes in women with gestational diabetes
mellitus: a randomized, controlled study. Sci Rep 2021;11(1):8866. https://doi.org/
10.1038/s41598-021-88329-x.
Articoli in evidenza
Infezioni vaginali o vaginiti: cause e sintomi
Le statistiche dimostrano che le infezioni vaginali colpiscono ogni donna almeno una volta nella vita. L’apparato genitale femminile è dotato di meccanismi difensivi capace di proteggerlo dall’attacco di microrganismi patogeni.
Menopausa: sintomi, disturbi e rimedi
La menopausa è una fase fisiologica della vita della donna che corrisponde alla cessazione della funzione ovarica, ovvero al termine del ciclo mestruale e dell’età fertile.
Seno denso: rischi e rimedi
Alle donne con età vicina o superiore ai 40 anni, viene consigliato di ripetere l’esame mammografico ogni 1/2 anni in base alla storia familiare, per rintracciare eventuali cambiamenti nei tessuti. Infatti, monitorando lo stato di salute del seno, si può intervenire tempestivamente nei casi di diagnosi tumorale.